高中化学人教版选修4 第一章 单元测试卷
试卷日期:2018-02-08 考试类型:同步测试
一、选择题
-
1. 下列说法不正确的是( )A、化学反应除了生成新物质外,还伴随着能量的变化 B、放热反应都不需要加热就能发生 C、吸热反应在一定条件(如高温、加热等)下也能发生 D、化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量2. 已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。现有以下四个化学反应方程式:①H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l);②H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l);③HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);④CH3COOH(aq)+NH3·H2O(aq)=CH3COONH4(aq)+H2O(l),其中放出的热量为57.3 kJ的是( )A、①和② B、③ C、④ D、以上都不对3. 对于:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l) ΔH=-5 800 kJ·mol-1的叙述错误的是( )A、该反应的反应热为ΔH=-5 800 kJ·mol-1 , 是放热反应 B、该反应的ΔH与各物质的状态有关,与化学计量数也有关 C、该式的含义为:25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ D、该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5 800 kJ·mol-14. 下列关于反应能量的说法正确的是( )A、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1 , 则反应物总能量>生成物总能量 B、相同条件下,如果1 mol氢原子所具有的能量为E1 , 1 mol氢分子所具有的能量为E2 , 则2E1=E2 C、101 kPa时,2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 , 则H2的燃烧热为571.6 kJ·mol-1 D、H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 , 则含1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量5. 分析下图的能量变化,确定该反应的热化学方程式书写正确的是( )
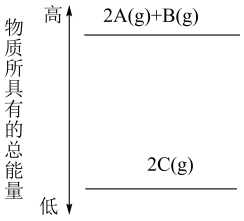 A、2A(g)+B(g)=2C(g) ΔH<0 B、2A(g)+B(g)=2C(g) ΔH>0 C、2A+B=2C ΔH<0 D、2C=2A+B ΔH<06. 下列关于热化学反应的描述中正确的是( )A、HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1 , 则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol-1 B、CO(g)的燃烧热是283.0kJ·mol-1 , 则2CO2(g)=2CO(g)+O2(g)的ΔH=2×(+283.0) kJ·mol-1 C、需要加热才能发生的反应一定是吸热反应 D、1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热7. 表示戊烷燃烧热的热化学方程式正确的是( )A、C5H12(l)+8O2(g)=5CO2(g)+6H2O(l) ΔH=-3 540 kJ·mol-1 B、C5H12(l)+8O2(g)=5CO2(g)+6H2O(g) ΔH=-3 540 kJ·mol-1 C、C5H12(l)+8O2(g)=5CO2(g)+6H2O(g) ΔH=+3 540 kJ·mol-1 D、C5H12(l)+8O2(g)=5CO2(g)+6H2O(l) ΔH=+3 540 kJ·mol-18. 在36 g碳不完全燃烧所得气体中,CO占 体积,CO2占 体积。且有:
A、2A(g)+B(g)=2C(g) ΔH<0 B、2A(g)+B(g)=2C(g) ΔH>0 C、2A+B=2C ΔH<0 D、2C=2A+B ΔH<06. 下列关于热化学反应的描述中正确的是( )A、HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1 , 则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol-1 B、CO(g)的燃烧热是283.0kJ·mol-1 , 则2CO2(g)=2CO(g)+O2(g)的ΔH=2×(+283.0) kJ·mol-1 C、需要加热才能发生的反应一定是吸热反应 D、1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热7. 表示戊烷燃烧热的热化学方程式正确的是( )A、C5H12(l)+8O2(g)=5CO2(g)+6H2O(l) ΔH=-3 540 kJ·mol-1 B、C5H12(l)+8O2(g)=5CO2(g)+6H2O(g) ΔH=-3 540 kJ·mol-1 C、C5H12(l)+8O2(g)=5CO2(g)+6H2O(g) ΔH=+3 540 kJ·mol-1 D、C5H12(l)+8O2(g)=5CO2(g)+6H2O(l) ΔH=+3 540 kJ·mol-18. 在36 g碳不完全燃烧所得气体中,CO占 体积,CO2占 体积。且有:C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283 kJ·mol-1
与这些碳完全燃烧相比,损失的热量是( )
A、172.5 kJ B、1 149 kJ C、283 kJ D、517.5 Kj9. 在1 200 ℃时,天然气脱硫工艺中会发生下列反应①H2S(g)+ O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g) ΔH2
③H2S(g)+ O2(g)=S(g)+H2O(g) ΔH3
④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为( )
A、ΔH4= (ΔH1+ΔH2-3ΔH3) B、ΔH4= (3ΔH3-ΔH1-ΔH2) C、ΔH4= (ΔH1+ΔH2-3ΔH3) D、ΔH4= (ΔH1-ΔH2-3ΔH3)10. 已知:P4(g)+6Cl2(g)=4PCl3(g) ΔH=a kJ·mol-1 ,P4(g)+10Cl2(g)=4PCl5(g) ΔH=b kJ·mol-1 ,
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1 , PCl3中P—Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是( )
A、P—P键的键能大于P—Cl键的键能 B、可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH C、Cl—Cl键的键能为 kJ·mol-1 D、P—P键的键能为 kJ·mol-111. 将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可知( )A、NH4HCO3和盐酸的反应是放热反应 B、该反应中,热能转化为产物内部的能量 C、反应物的总能量高于生成物的总能量 D、反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q12. 工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ·mol-1下列判断正确的是( )
A、反应物能量总和大于生成物能量总和 B、CO(g)+H2(g)→C(s)+H2O(l) ΔH=-131.4 kJ·mol-1 C、水煤气反应中生成1 mol H2(g)吸收131.4 kJ热量 D、水煤气反应中生成1体积CO(g)吸收131.4 kJ热量13. SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)=SF6(g)的反应热ΔH为( )A、-1 780 kJ·mol-1 B、-1 220 kJ·mol-1 C、-450 kJ·mol-1 D、+430 kJ·mol-114. 根据碘与氢气反应的热化学方程式(ⅰ)I2(g)+H2(g) 2HI(g) ΔH=-9.48 kJ·mol-1
(ⅱ)I2(s)+H2(g) 2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A、254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ B、1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ C、反应(ⅰ)的产物比反应(ⅱ)的产物稳定 D、反应(ⅱ)的反应物的总能量比反应(ⅰ)的反应物的总能量低15. 下列与化学反应能量变化相关的叙述正确的是( )A、生成物总能量一定低于反应物总能量 B、放热反应的反应速率总是大于吸热反应的反应速率 C、应用盖斯定律,可计算某些难以直接测量的反应焓变 D、同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同16. 已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )A、-67.7 kJ·mol-1 B、-43.5 kJ·mol-1 C、+43.5 kJ·mol-1 D、+67.7 kJ·mol-1二、非选择题
-
17. 根据下图所示,写出反应的热化学方程式并回答问题:
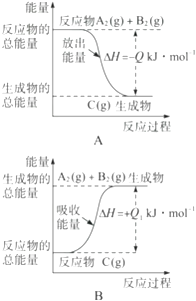 (1)、反应过程A的热化学方程式为;(2)、反应过程B的热化学方程式为;(3)、Q与Q1的关系:QQ1(填“大于”“小于”或“等于”)。18.(1)、广州亚运会“潮流”火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
(1)、反应过程A的热化学方程式为;(2)、反应过程B的热化学方程式为;(3)、Q与Q1的关系:QQ1(填“大于”“小于”或“等于”)。18.(1)、广州亚运会“潮流”火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
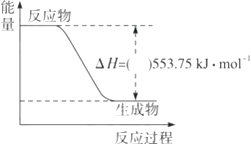
②写出表示丙烷燃烧热的热化学方程式:。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为。
(2)、科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。①P4(s,白磷)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(s,红磷)+ O2(g)= P4O10(s) ΔH2=-738.5 kJ·mol-1
则白磷转化为红磷的热化学方程式为。相同的状况下,能量较低的是;白磷的稳定性比红磷(填“高”或“低”)。
19. 用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2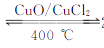 2Cl2+2H2O
2Cl2+2H2O 已知:i.反应A中, 4 mol HCl被氧化,放出115.6 kJ的热量。
ii.
 (1)、H2O的电子式是。(2)、反应A的热化学方程式是。(3)、断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”)。20.(1)、真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
(1)、H2O的电子式是。(2)、反应A的热化学方程式是。(3)、断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”)。20.(1)、真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ΔH=a kJ·mol-1
3AlCl(g)=2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH=kJ·mol-1(用含a、b的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为。
(2)、肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式。
(3)、已知:温度过高时,WO2(s)转变为WO2(g):WO2(s)+2H2(g) W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1
WO2(g)+2H2(g) W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1
则WO2(s) WO2(g)的ΔH=。