2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.3化学键
试卷日期:2018-02-08 考试类型:同步测试
一、选择题
-
1. 下列物质中只含有离子键的是( )A、H2O B、MgCl2 C、NH4Cl D、C2H5OH2. 下列元素的原子间反应形成的化学键是离子键的一组是( )
原子
a
b
c
d
e
f
g
M层电子数
1
2
3
4
5
6
7
A、a和c B、a和f C、d和g D、c和g3. 下列性质中,可以证明某化合物内一定存在离子键的是( )A、可溶于水 B、具有较高的熔点 C、水溶液能导电 D、熔融状态能导电4. 随着科技的进步,研究和制备物质的手段和途径越来越多,C60、H3、O、N等已被发现。下列有关说法正确的是( )A、H2和H3互为同位素 B、O中不含化学键 C、C60中含有共价键 D、N中含有离子键5. 下列关于化学键和化合物的说法中正确的是( )A、化学键的形成一定伴随着电子的得失 B、金属元素和非金属元素形成的化合物一定是离子化合物 C、非金属元素组成的化合物一定是共价化合物 D、含有阴离子的化合物中一定含有阳离子6. 下列变化需克服相同类型作用力的是( )A、碘和干冰的升华 B、硅和C60的熔化 C、氯化氢和氯化钾的溶解 D、溴和汞的气化7. 下列说法正确的是( )A、分子间作用力与化学键的大小相当 B、分子间作用力的大小远大于化学键,是一种很强的作用力 C、分子间作用力主要影响物质的化学性质 D、分子内部的相邻原子之间强烈的相互作用称为化学键,而分子之间也存在相互作用,称为分子间作用力8. 关于氢键,下列说法中正确的是( )A、每个水分子内含有两个氢键 B、在水蒸气、水和冰中都含有氢键 C、分子间若形成氢键,则物质的熔点和沸点较高 D、HF的稳定性很强,是因为其分子间能形成氢键9. 下列说法正确的是( )A、MgCl2的形成过程可表示为·Mg·+2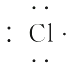 →Mg2+
→Mg2+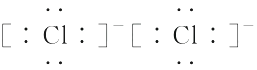 B、H2O分子的结构式可表示为H—O—H
C、NaOH是离子化合物,所以不含共价键
D、Na2S的电子式为Na
B、H2O分子的结构式可表示为H—O—H
C、NaOH是离子化合物,所以不含共价键
D、Na2S的电子式为Na 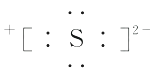 10. 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
10. 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )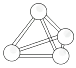 A、N4分子属于一种新型的化合物 B、N4分子中只含有非极性键 C、1 mol N4分子所含共价键数为4NA D、N4沸点比P4(白磷)高
A、N4分子属于一种新型的化合物 B、N4分子中只含有非极性键 C、1 mol N4分子所含共价键数为4NA D、N4沸点比P4(白磷)高二、非选择题
-
11. 现有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl
(1)、只由离子键构成的物质是。(2)、只由极性键构成的物质是。(3)、只由非极性键构成的物质是。(4)、只由非金属元素组成的离子化合物是。(5)、由极性键和非极性键构成的物质是。(6)、由离子键和极性键构成的物质是。(7)、由离子键和非极性键构成的物质是。(8)、属于离子化合物的物质是。(9)、属于共价化合物的物质是。12. 下面是同学们熟悉的物质:①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3 ⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)、这些物质中,只含有共价键的是(填序号,下同);只含有离子键的是;既含有共价键又含有离子键的是;不存在化学键的是。(2)、属于共价化合物的是;属于离子化合物的是。(3)、将NaHSO4溶于水,破坏了NaHSO4中的 , 写出其电离方程式;NaHSO4在熔融状态下电离,破坏了 , 写出其电离方程式。
13. 现有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A原子的电子式为 ,B原子L层的电子数是K层的3倍;0.1 mol C单质能从酸中置换出2.24 L氢气(标准状况),同时它的电子层结构变得与氖原子相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。 (1)、写出元素A、B、C、D的名称:
,B原子L层的电子数是K层的3倍;0.1 mol C单质能从酸中置换出2.24 L氢气(标准状况),同时它的电子层结构变得与氖原子相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。 (1)、写出元素A、B、C、D的名称:A. , B. , C. ,
D.。
(2)、D元素在元素周期表中位于第周期第族。(3)、用电子式表示A的气态氢化物的形成过程:。(4)、A和B的单质充分反应生成化合物的结构式是。(5)、B与C形成的化合物是离子化合物还是共价化合物?如何证明?14. 原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成共价化合物XH3、H2Z和HW;Y与氧元素可形成离子化合物Y2O和Y2O2。(1)、写出Y2O2的化学式: , 其中含有的化学键是。(2)、X、Z、W三种元素的最高价氧化物对应的水化物酸性最强的是(填写化学式)。(3)、XH3、H2Z和HW三种化合物中与另外两种都能反应的是(填写化学式),生成物属于(填“离子”或“共价”)化合物。(4)、写出下列物质的电子式:①XW3:;
②Y2Z:。
(5)、X的气态氢化物的结构式为。15. 对于周期表中下列位置的①~⑩十种元素,根据有关要求回答: (1)、能形成共价键的元素共有种。(2)、只需形成一个共价单键就能达到稳定结构的元素有(填元素符号)。(3)、气态氢化物溶于水生成的呈碱性的化合物是(填化学式)。(4)、⑩号元素最高正价含氧酸只含有键。(5)、①⑤⑦形成的化合物的电子式为。(6)、某元素的气态氢化物为H2B,其最高价氧化物中B的质量分数为40%,则其气态氢化物的电子式为 , 它与③的化合物的分子式为 , 含有的化学键类型有。
(1)、能形成共价键的元素共有种。(2)、只需形成一个共价单键就能达到稳定结构的元素有(填元素符号)。(3)、气态氢化物溶于水生成的呈碱性的化合物是(填化学式)。(4)、⑩号元素最高正价含氧酸只含有键。(5)、①⑤⑦形成的化合物的电子式为。(6)、某元素的气态氢化物为H2B,其最高价氧化物中B的质量分数为40%,则其气态氢化物的电子式为 , 它与③的化合物的分子式为 , 含有的化学键类型有。