2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.2.1原子核外电子的排布
试卷日期:2018-02-08 考试类型:同步测试
一、选择题
-
1. 下图微粒的结构示意图,正确的是( )A、
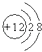 Mg2+
B、
Mg2+
B、 Cl
C、
Cl
C、 Ar
D、K
Ar
D、K  2. 根据下图微粒结构示意图的共同特征,可以把三种微粒
2. 根据下图微粒结构示意图的共同特征,可以把三种微粒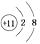 、
、 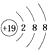 、
、 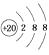 归为一类,下列微粒中也可以归为这一类的是( ) A、
归为一类,下列微粒中也可以归为这一类的是( ) A、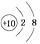 B、
B、 C、
C、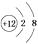 D、
D、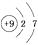 3. 原子核外任意电子层上所容纳电子的最大数目为2n2。下列叙述不正确的是( )A、n只能取1时,对应的元素最多有2种 B、n=3时,该电子层上的电子数一定是18 C、n=3时,该电子层上的电子数可能是6 D、n只能取2时,有关原子的核外有2个电子离原子核最近、能量最低4. 短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )A、C>D>B>A B、D>B>A>C C、A>D>C>B D、B>A>C>D5. A、B两种原子,A的M电子层比B的M电子层少3个电子,B的L电子层电子数恰为A的L电子层电子数的2倍。A和B分别是( )A、硅原子和钠原子 B、硼原子和氦原子 C、氯原子和碳原子 D、碳原子和铝原子6. 下列比较中正确的是( )A、原子半径:Na>Mg B、碱性:NaOH>KOH C、结合H+的能力:CO32-<Cl- D、还原性:I-<Br-7. 短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是( )A、原子序数A>B B、电子总数A->B2+ C、离子半径A->B2+ D、原子半径A>B8. 金属元素(前18号)甲~戊在元素周期表中的相对位置如图所示,下列判断中正确的是( )
3. 原子核外任意电子层上所容纳电子的最大数目为2n2。下列叙述不正确的是( )A、n只能取1时,对应的元素最多有2种 B、n=3时,该电子层上的电子数一定是18 C、n=3时,该电子层上的电子数可能是6 D、n只能取2时,有关原子的核外有2个电子离原子核最近、能量最低4. 短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )A、C>D>B>A B、D>B>A>C C、A>D>C>B D、B>A>C>D5. A、B两种原子,A的M电子层比B的M电子层少3个电子,B的L电子层电子数恰为A的L电子层电子数的2倍。A和B分别是( )A、硅原子和钠原子 B、硼原子和氦原子 C、氯原子和碳原子 D、碳原子和铝原子6. 下列比较中正确的是( )A、原子半径:Na>Mg B、碱性:NaOH>KOH C、结合H+的能力:CO32-<Cl- D、还原性:I-<Br-7. 短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是( )A、原子序数A>B B、电子总数A->B2+ C、离子半径A->B2+ D、原子半径A>B8. 金属元素(前18号)甲~戊在元素周期表中的相对位置如图所示,下列判断中正确的是( )甲
乙
丙
丁
戊
A、原子半径:丙<丁<戊 B、金属性:甲>丙 C、氢氧化物碱性:丙>丁>戊 D、最外层电子数:甲>乙9. 下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )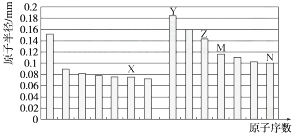 A、Z、N两种元素的离子半径相比,前者较大 B、X、N两种元素的气态氢化物的沸点相比,前者较低 C、由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 D、Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液10. W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。
A、Z、N两种元素的离子半径相比,前者较大 B、X、N两种元素的气态氢化物的沸点相比,前者较低 C、由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 D、Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液10. W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。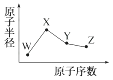
已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是( )
A、对应简单离子半径:X<W B、对应简单气态氢化物的稳定性:Y<Z C、与Z元素同主族的元素最高价态均为+7 D、Y的氧化物能与X的最高价氧化物对应的水化物反应二、非选择题
-
11. A、B、C为短周期元素,在周期表中所处的位置如图所示。

A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)、写出A、B、C三元素名称: 、 、 。
(2)、C在元素周期表中的位置是
(3)、B的原子结构示意图为 , C的氢化物与B的氢化物的稳定性强弱顺序为> (填化学式)。
(4)、比较A、C的原子半径:A (填“>”或“<”)C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式: 。
12. A、B、C、D都是核外电子总数为10的微粒。(1)、A为中性微粒。如果A能刻蚀玻璃,则A是(填化学式,下同);如果A的水溶液显碱性,则A是。(2)、B是带电微粒。如果B为阳离子且其水溶液能使紫色石蕊溶液变红,则B是;如果B为阴离子且其水溶液能使无色酚酞溶液变红,则B是。(3)、若1个C微粒中含有5个原子,带正电荷,遇碱放出NH3 , 则C是。(4)、若D微粒遇阴离子B,先生成沉淀,后沉淀溶解,则D是。13. 下表为元素周期表的一部分,请回答有关问题: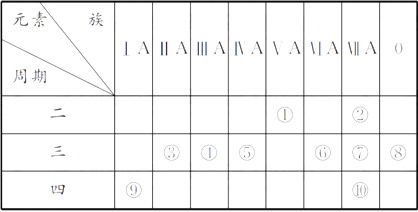 (1)、⑤和⑧的元素符号分别是和。(2)、表中最活泼的金属是 , 非金属性最强的元素是(填元素符号,下同)。(3)、表中能形成两性氢氧化物的元素是 , 分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物的水化物反应的化学方程式:。(4)、请设计一个实验方案,比较⑦和⑩的单质氧化性的强弱:。14. W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。
(1)、⑤和⑧的元素符号分别是和。(2)、表中最活泼的金属是 , 非金属性最强的元素是(填元素符号,下同)。(3)、表中能形成两性氢氧化物的元素是 , 分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物的水化物反应的化学方程式:。(4)、请设计一个实验方案,比较⑦和⑩的单质氧化性的强弱:。14. W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。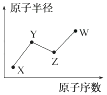
已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。请回答下列问题:
(1)、写出四种元素的元素符号:W;X;Y;Z。
(2)、四种元素的所有化合价中,最低负化合价为价,最高正化合价为价。(3)、甲和乙分别是由W、X、Y、Z四种元素中的三种元素组成的常见化合物,化合物甲具有消毒杀菌作用,其化学式为;化合物乙是一种常见的化肥,其化学式为。(4)、HYO3的酸性比HWO强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确,说明理由:。15. 某同学设计实验以探究元素性质的递变规律,实验装置如图所示。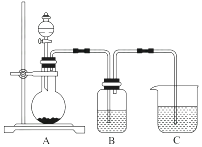
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3 , B装置中装有饱和碳酸氢钠溶液,C装置中装有Na2SiO3溶液,试回答:
(1)、A中反应的离子方程式为 , C中可观察到的现象是。(2)、B装置的作用是。(3)、根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是 , 由此得出碳、硅、氮三种元素非金属性的强弱顺序是。(4)、实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱。写出B装置中发生反应的离子方程式:。
(5)、C装置的作用是。(6)、实验结论:氧化性 , 非金属性:。