2017_2018学年高中化学新人教版必修二 第一章物质结构元素周期律1.1.2元素的性质与原子结构
试卷日期:2018-02-08 考试类型:同步测试
一、选择题
-
1. 有下列实验仪器或用品:
a.试管夹 b.镊子 c.小刀 d.冷凝管
e.滤纸 f.研钵 g.坩埚 h.石棉网
i.玻璃片 j.培养皿
要演示钾和水反应的实验,需要用到上述仪器和用品中的( )A、3种 B、4种 C、5种 D、6种2. 往碘化钾溶液中先加入氯水,再加入CCl4振荡,静置后出现分层,下层呈( )A、橙红色 B、紫红色 C、无色 D、深褐色3. 下列对碱金属性质的叙述中,正确的是( )
①都是银白色的柔软金属(除铯外),密度都比较小
②单质在空气中燃烧生成的都是过氧化物
③碱金属单质都与水剧烈反应
④单质的熔、沸点随着原子序数的增加而升高A、①③ B、②④ C、①④ D、②③4. 关于碱金属元素的说法中正确的是( )A、第ⅠA族元素都是碱金属元素 B、碱金属单质可将铜从其盐溶液中置换出来 C、金属钾具有强还原性,K+具有强氧化性 D、Cs常温下与水反应会发生爆炸5. X、Y是元素周期表中第ⅥA族的两种元素。下列叙述中能说明X的非金属性比Y强的是( )A、X原子的电子层数比Y原子的电子层数多 B、X的气态氢化物比Y的气态氢化物稳定 C、Y的单质能将X从KX的溶液中置换出来 D、Y的最高价氧化物对应的水化物的酸性比X的最高价氧化物对应的水化物的酸性强6. 下列关于卤族元素由上到下性质递变规律的叙述,正确的是( )①单质的氧化性增强
②单质的颜色加深
③气态氢化物的稳定性增强
④单质的沸点升高
⑤阴离子的还原性增强
A、①②③ B、②③④ C、②④⑤ D、①③⑤7. 如图表示碱金属的某些性质与核电荷数的变化关系,则下列各性质中不符合图示关系的是( ) A、还原性 B、与水反应的剧烈程度 C、熔点 D、原子半径8. 下列关于卤素(用X表示)的叙述正确的是( )A、其单质都能与水反应,通式为X2+H2O=HX+HXO B、HX易溶于水,其水溶液都是强酸 C、其单质都有颜色,都有毒 D、最高价含氧酸的通式为HXO49. 关于铯及其化合物的以下各说法中不正确的是( )A、氢氧化铯是一种强碱,比KOH的碱性强 B、铯与水或酸溶液反应剧烈,都生成氢气 C、Cs的还原性比Na强,故Na+的氧化性强于Cs+ D、Al的金属性强于Cs的金属性10. 现已合成第117号元素X,它的原子结构与卤族元素相似,电子排布有7个电子层,且最外层有7个电子。下列叙述中正确的是( )A、此X元素的气态氢化物的化学式为HX,在常温下很稳定 B、其单质带有金属光泽,具有强氧化性,可与KI发生置换反应生成I2 C、其单质的分子式为X2 , 易溶于有机溶剂 D、AgX是一种有色的易溶于水的化合物
A、还原性 B、与水反应的剧烈程度 C、熔点 D、原子半径8. 下列关于卤素(用X表示)的叙述正确的是( )A、其单质都能与水反应,通式为X2+H2O=HX+HXO B、HX易溶于水,其水溶液都是强酸 C、其单质都有颜色,都有毒 D、最高价含氧酸的通式为HXO49. 关于铯及其化合物的以下各说法中不正确的是( )A、氢氧化铯是一种强碱,比KOH的碱性强 B、铯与水或酸溶液反应剧烈,都生成氢气 C、Cs的还原性比Na强,故Na+的氧化性强于Cs+ D、Al的金属性强于Cs的金属性10. 现已合成第117号元素X,它的原子结构与卤族元素相似,电子排布有7个电子层,且最外层有7个电子。下列叙述中正确的是( )A、此X元素的气态氢化物的化学式为HX,在常温下很稳定 B、其单质带有金属光泽,具有强氧化性,可与KI发生置换反应生成I2 C、其单质的分子式为X2 , 易溶于有机溶剂 D、AgX是一种有色的易溶于水的化合物二、非选择题
-
11.(1)、常见卤素氢化物中最不稳定的是(写化学式)。(2)、下列单质熔、沸点随原子序数递增而升高的是________(填字母,下同)。A、碱金属元素 B、卤族元素(3)、下列反应中,更剧烈的是________。A、钠与水反应 B、钾与水反应(4)、取下列溶液分装两试管,再分别依次加入少量氯水和少量四氧化碳,用力振荡、静置后,四氯化碳层显紫红色的是________。A、溴化钠溶液 B、碘化钾溶液12. 已知元素aA、bB、cC、dD、eE的原子的结构示意图分别为
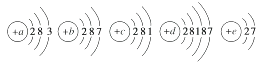
请回答下列问题:
(1)、属于同周期的元素是(填元素符号,下同),属于同主族的元素。(2)、金属性最强的元素是 , 非金属性最强的元素是。(3)、上述元素中最高价氧化物对应的水化物碱性最强的是。13. 下表是元素周期表的一部分,回答下列有关问题: (1)、写出下列元素符号:②、⑦、⑧、⑫。(2)、在这些元素中,最活泼的金属元素是(填元素符号,后同),最活泼的非金属元素是 , 最不活泼的元素是。(3)、在这些元素的最高价氧化物的水化物中,碱性最强的是(填化学式,后同),呈两性的氢氧化物是 , 写出二者之间相互反应的化学方程式(4)、在①与⑦中,非金属性较强的是(填序号),请列举两项事实加以证明:
(1)、写出下列元素符号:②、⑦、⑧、⑫。(2)、在这些元素中,最活泼的金属元素是(填元素符号,后同),最活泼的非金属元素是 , 最不活泼的元素是。(3)、在这些元素的最高价氧化物的水化物中,碱性最强的是(填化学式,后同),呈两性的氢氧化物是 , 写出二者之间相互反应的化学方程式(4)、在①与⑦中,非金属性较强的是(填序号),请列举两项事实加以证明:。
14. 常温下,KMnO4固体和浓盐酸反应产生氯气。为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。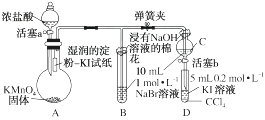
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)、验证氯气的氧化性强于碘的实验现象是。(2)、B中溶液发生反应的离子方程式是。(3)、为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是。(4)、过程Ⅲ实验的目的是。(5)、氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,电子层数依次增多, , 得电子能力逐渐减弱,非金属性逐渐减弱。