2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.2海水资源的开发利用
试卷日期:2018-02-08 考试类型:同步测试
一、选择题
-
1. 海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )。A、海水中含有钾元素,只需经过物理变化就可以得到钾单质 B、海水蒸发制海盐的过程中只发生了化学变化 C、从海水中可以得到NaCl,电解熔融NaCl可制备Cl2 D、利用潮汐发电是将化学能转化为电能2. 若将海水淡化作饮用水使用,下列方法在原理上完全不可行的是( )A、加明矾使海水中的盐分沉淀而淡化 B、利用太阳能使海水蒸馏淡化 C、利用电渗析法可以获取淡化的饮用水 D、将海水通过离子交换树脂,以除去所含离子3. 许多国家十分重视海水资源的综合利用,不需要化学变化就能从海水中获得的物质是( )A、Cl2、Br2、I2 B、Na、Mg、Al C、食盐、淡水 D、NaOH、H24. NaCl是海水中提取出来的一种重要物质,除食用外,它还是一种工业原料。下列以NaCl为原料的产品(或物质)是( )
①烧碱 ②纯碱 ③金属钠 ④氯气 ⑤盐酸
A、①②③④⑤ B、①②③④ C、①②③⑤ D、①②④⑤5. 某同学设计实验从海带中提取碘:①滴加稀硫酸和双氧水;②在海带中加入少量酒精,点燃使其燃烧为灰烬,在灰烬中加水搅拌;③加四氯化碳并振荡;④过滤;⑤分液.该实验的合理操作顺序是( )A、①③⑤②④ B、②①③④⑤ C、②④①③⑤ D、③①②⑤④6. 下列有关说法不正确的是( )A、工业上可利用海水制取镁 B、实验室可用海带为原料获得碘 C、工业上可用还原剂还原赤铁矿(含Fe2O3)获得铁 D、从海水中提取溴元素(以Br-形式存在),可以考虑向其中通入F27. 海水提溴过程中将Br-氧化成Br2 , 可向其中加入氧化剂,合适的是( )A、酸性KMnO4溶液 B、氯水 C、FeCl3溶液 D、碘水8. 从海带中提取碘的实验过程中涉及下列操作,其中正确的是( )A、 将海带灼烧成灰
B、
将海带灼烧成灰
B、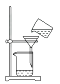 过滤得含I-的盐
C、
过滤得含I-的盐
C、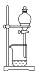 放出碘的苯溶液
D、
放出碘的苯溶液
D、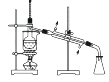 分离碘并回收苯
9. 海洋中蕴藏着巨大的化学资源,下列有关海水综合利用的说法正确的是( )A、蒸发海水可以生产单质碘 B、蒸馏海水可以得到淡水 C、电解海水可以得到单质镁 D、电解海水可以制得金属钠10. 海水开发利用的部分过程如图所示。下列说法错误的是( )
分离碘并回收苯
9. 海洋中蕴藏着巨大的化学资源,下列有关海水综合利用的说法正确的是( )A、蒸发海水可以生产单质碘 B、蒸馏海水可以得到淡水 C、电解海水可以得到单质镁 D、电解海水可以制得金属钠10. 海水开发利用的部分过程如图所示。下列说法错误的是( ) A、向苦卤中通入Cl2是为了提取溴 B、粗盐可采用除杂和重结晶等过程提纯 C、工业生产中常选用NaOH作为沉淀剂 D、富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
A、向苦卤中通入Cl2是为了提取溴 B、粗盐可采用除杂和重结晶等过程提纯 C、工业生产中常选用NaOH作为沉淀剂 D、富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收二、非选择题
-
11. 海水是可以综合利用的。从海水中提取食盐和溴的过程如下:
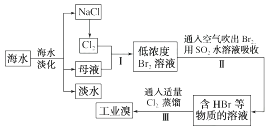 (1)、请写出一种海水淡化的方法:。(2)、步骤Ⅰ获取Br2的离子方程式为。(3)、步骤Ⅱ用SO2水溶液吸收Br2 , 使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,还原剂是(填化学式)。若反应中生成4 mol HBr,则消耗mol SO2。12. 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了相关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如图所示装置简图:
(1)、请写出一种海水淡化的方法:。(2)、步骤Ⅰ获取Br2的离子方程式为。(3)、步骤Ⅱ用SO2水溶液吸收Br2 , 使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,还原剂是(填化学式)。若反应中生成4 mol HBr,则消耗mol SO2。12. 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了相关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如图所示装置简图:
请你参与分析讨论:
(1)、图中仪器B的名称:。(2)、整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是。(3)、实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:。(4)、C中液体产物颜色为。为除去该产物中仍残留的少量Cl2 , 可向其中加入NaBr溶液,充分反应后,再进行的分离操作是。13. 海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下: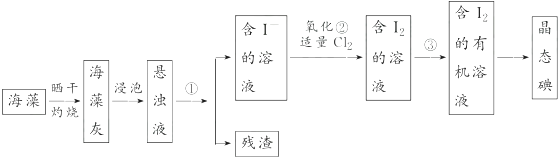 (1)、指出从海藻中提取I2的实验操作名称:
(1)、指出从海藻中提取I2的实验操作名称:① , ③ , 反应②的离子方程式。
(2)、提取碘的过程中,可供选择的有机溶剂是________。A、甲苯、酒精 B、四氯化碳、苯 C、汽油、乙酸 D、汽油、甘油(3)、为使海藻中I-转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器。还缺少的仪器是。(4)、从含碘的有机溶剂中提取碘,还要经过蒸馏,指出下列蒸馏装置中的错误之处。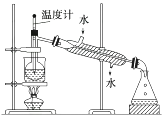 (5)、进行蒸馏操作时,使用水浴加热的原因是 , 最后晶态碘在中。14. 镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
(5)、进行蒸馏操作时,使用水浴加热的原因是 , 最后晶态碘在中。14. 镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下: (1)、为了使MgSO4转化为Mg(OH)2 , 试剂①可以选用 , 要使MgSO4完全转化为沉淀,加入试剂的量应。(2)、加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是。(3)、试剂②选用;其反应的离子方程式为。(4)、无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为。
(1)、为了使MgSO4转化为Mg(OH)2 , 试剂①可以选用 , 要使MgSO4完全转化为沉淀,加入试剂的量应。(2)、加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是。(3)、试剂②选用;其反应的离子方程式为。(4)、无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为。