2017_2018学年高中化学新人教版必修二 第四章化学与自然资源的开发利用4.1.1金属矿物的开发利用课时作业
试卷日期:2018-02-08 考试类型:同步测试
一、选择题
-
1. 下列金属:①铁 ②镁 ③锰 ④钒 ⑤铬,可用铝热法制备的有( )A、①②④ B、①②③⑤ C、①③④⑤ D、①②③④⑤2. 下列反应原理中,不符合工业冶炼金属实际情况的是( )A、2HgO 2Hg+O2↑ B、4Al+3MnO2 2Al2O3+3Mn C、2MgO 2Mg+O2↑ D、4CO+Fe3O4 3Fe+4CO23. 从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。如图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于( )
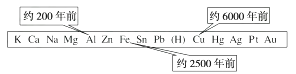 A、金属的导电性强弱 B、金属在地壳中的含量多少 C、金属的化合价高低 D、金属的活动性强弱4. 金属锂是密度最小的金属,等质量的金属,锂能释放出更多的电子,故常用来制造高能量电池。已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的方法是( )A、电解法 B、热还原法 C、热分解法 D、铝热法5. 在熔融状态下,Na与KCl存在可逆反应:Na+KClNaCl+K,通过调整温度,可利用金属Na来制取K。
A、金属的导电性强弱 B、金属在地壳中的含量多少 C、金属的化合价高低 D、金属的活动性强弱4. 金属锂是密度最小的金属,等质量的金属,锂能释放出更多的电子,故常用来制造高能量电池。已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的方法是( )A、电解法 B、热还原法 C、热分解法 D、铝热法5. 在熔融状态下,Na与KCl存在可逆反应:Na+KClNaCl+K,通过调整温度,可利用金属Na来制取K。物质
K
Na
KCl
NaCl
熔点/℃
63.6
97.8
770
801
沸点/℃
774
883
1500
1413
根据上表的熔点和沸点,确定由Na与KCl反应制取K的合适温度为( )
A、770 ℃ B、801 ℃ C、850 ℃ D、770~801 ℃6. 用铝热法还原下列化合物,若获得金属各1 mol,消耗铝最少的是( )A、MnO2 B、Cr2O3 C、WO3 D、CuO7. 下列说法错误的是( )A、对废旧金属的最好处理方法是回收、再利用 B、提炼金属要经过矿石的富集、冶炼、精炼三步 C、活泼金属的冶炼都是通过电解其盐溶液 D、热还原法中还原剂有焦炭、一氧化碳、氢气和活泼金属等8. 以辉铜矿(Cu2S)为原料冶炼铜,其反应原理可表示为Cu2S+O2 2Cu+SO2。下列说法不正确的是( )A、化合价发生变化的元素有3种 B、Cu2S在该反应中既是氧化剂又是还原剂 C、1 mol O2参加反应时,上述反应转移电子总物质的量为4 mol D、SO2被分离、回收后氧化生成SO3 , 作为制取硫酸的原料9. 钛是一种活泼金属,具有密度小、熔点高、可塑性强、机械强度高等性能。工业上常用硫酸分解铁钛矿石来制备二氧化钛,用以冶炼钛,主要有以下五个反应:①FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
②TiOSO4+2H2O=H2TiO3↓+H2SO4
③H2TiO3 TiO2+H2O
④TiO2+2C+2Cl2 TiCl4+2CO
⑤TiCl4+2Mg 2MgCl2+Ti
针对以上五个反应,下列叙述错误的是( )
A、反应①是非氧化还原反应 B、反应②生成了两种酸 C、反应④中的TiO2是氧化剂 D、反应⑤表现了金属镁比金属钛的还原性强二、非选择题
-
10.(1)、Al与Fe3O4发生铝热反应的化学方程式为 , 该反应中氧化剂是 , 还原剂是。(2)、工业上电解冶炼铝的化学方程式为。若电路中通过1 mol电子,可以得到Al g。11. 冶炼金属一般有下列方法:①焦炭法;②水煤气(或氢气或一氧化碳)法;③活泼金属置换法;④电解法。四种方法在工业上均有应用。(1)、请对下表中的金属冶炼方法进行分析,从上述四种方法中选择相应的序号填入表中空格:
 (2)、请再举出使用上述方法冶炼金属的例子各一个(用化学方程式表示):
(2)、请再举出使用上述方法冶炼金属的例子各一个(用化学方程式表示):①;
②;
③;
④。
12. 铁是地壳中含量很丰富的元素,金属铁是在高炉中冶炼的,在冶金工业中,常用焦炭来冶炼铁。(1)、写出焦炭在高炉中所参与的两个反应的化学方程式:。(2)、写出赤铁矿被CO还原成铁的化学方程式:。(3)、实验室中可用CO还原Fe2O3 , 在加热Fe2O3前应 , 直到无现象时才能点燃酒精灯加热,否则可能发生现象,未反应完全的CO(填“能”或“不能”)排放到大气中,应做处理。13. 铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物。某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验,实验装置如图所示。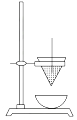 (1)、取磁性氧化铁按图所示装置进行铝热反应,引发铝热反应的实验操作是。取少许反应生成的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变为血红色。出现这种现象,一方面可能因为“铁块”中混有没反应的磁性氧化铁,另一方面可能因为。(2)、请写出此铝热反应的化学方程式: , 1 mol Al参与反应,转移的电子数为。(3)、设计一个简单的实验方案,证明上述所得的“铁块”中含有金属铝。该实验所用试剂是 , 反应的离子方程式为。(4)、除了磁性氧化铁可做铝热反应实验,下列试剂也可以发生铝热反应的是________(填字母,双选)。A、CuO B、Na2O2 C、MnO2 D、MgO14. 从铝土矿(主要成分是Al2O3 , 含SiO2、Fe2O3、MgO等杂质)中提取氧化铝通常有两种工艺,如图所示。因向铝土矿中加入NaOH时形成的赤泥(残渣)中常含有铝硅酸钠,故流程乙常处理SiO2含量小于8%的铝土矿,若SiO2含量较高则可采用流程甲来处理。
(1)、取磁性氧化铁按图所示装置进行铝热反应,引发铝热反应的实验操作是。取少许反应生成的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变为血红色。出现这种现象,一方面可能因为“铁块”中混有没反应的磁性氧化铁,另一方面可能因为。(2)、请写出此铝热反应的化学方程式: , 1 mol Al参与反应,转移的电子数为。(3)、设计一个简单的实验方案,证明上述所得的“铁块”中含有金属铝。该实验所用试剂是 , 反应的离子方程式为。(4)、除了磁性氧化铁可做铝热反应实验,下列试剂也可以发生铝热反应的是________(填字母,双选)。A、CuO B、Na2O2 C、MnO2 D、MgO14. 从铝土矿(主要成分是Al2O3 , 含SiO2、Fe2O3、MgO等杂质)中提取氧化铝通常有两种工艺,如图所示。因向铝土矿中加入NaOH时形成的赤泥(残渣)中常含有铝硅酸钠,故流程乙常处理SiO2含量小于8%的铝土矿,若SiO2含量较高则可采用流程甲来处理。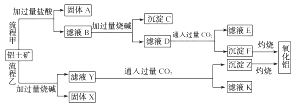
请回答下列问题:
(1)、流程甲加入盐酸后生成Al3+的离子方程式为。(2)、流程乙加入烧碱后生成SiO的离子方程式为。(3)、流程甲滤液D中通入过量CO2反应的化学方程式为。(4)、“通入过量CO2”能否改用盐酸(填“能”或“不能”),原因是。(5)、滤液E、K中溶质的主要成分是(填化学式),写出该溶质的一种用途。