辽宁省葫芦岛市六校协作体2016-2017学年高一下学期化学开学考试试卷
试卷日期:2018-02-08 考试类型:开学考试
一、单选题
-
1. 进行化学实验必须注意安全,下列说法不正确的是( )A、不慎将酸液溅到眼中,应立即用大量水冲洗,边洗边眨眼睛 B、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 C、洒在桌面上的酒精燃烧,立即用湿抹布盖灭 D、进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出2. 随着人们对物质组成和性质研究的深入,物质的分类也更加多样化.下列有关说法正确的是( )A、H2SO4、NaOH、NaNO3都是强电解质 B、Na2O、Al2O3、Fe2O3都是碱性氧化物 C、铝土矿、小苏打都是混合物 D、烧碱、纯碱、熟石灰都是碱3. 设NA表示阿伏加德罗常数的值,下列说法中正确的是( )A、1 mol NH4+ 所含质子数为10NA B、2克氢气所含原子数约为6.02×1023 C、标准状况下,22.4 L SO3所含的分子数为NA D、常温常压下,32 g O2和O3的混合气体所含原子数为2NA4. 下列离子方程式书写正确的是( )A、钠与水反应:Na+H2O= Na++OH-+H2↑ B、铁与硫酸铁溶液反应:Fe+Fe3+ = 2Fe2+ C、氢氧化镁与稀盐酸反应:Mg(OH)2+2 H+ = Mg2++2H2O D、碳酸氢钠溶液中滴入氢氧化钠溶液:OH-+HCO3-= H2O+CO2↑5. 下列溶液与100 mL 0.5 mol/L NaCl溶液中所含的Cl-物质的量浓度相同的是( )A、100 mL 0.5 mol/L MgCl2溶液 B、200 mL 0.25 mol/L AlCl3溶液 C、50 mL 1 mol/L NaCl溶液 D、25 mL 0.5 mol/L HCl溶液6. 在一定条件下,RO3n-和F2可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O,从而可知在RO3n-中,元素R的化合价是( )A、+4价 B、+5价 C、+6价 D、+7价7. 下面关于硅的叙述中,正确的是( )A、硅是亲氧元素,在自然界中以化合态存在 B、硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位 C、硅的活泼性比碳强,只有在高温下才能跟氢气起化合反应 D、二氧化硅在电子工业中,是重要的半导体材料8. “绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是 ( )
①实验室收集氨 气采用图1所示装置②实验室中做氯气与钠的反应实验时采用图2所示装置③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验④实验室中采用图3所示装置进行铜与稀硝酸的反应
 A、①②④ B、①②③ C、②③④ D、①③④9. 在稀硫酸中加入铜粉,铜粉不溶解,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④KNO3 , 铜粉可溶解的是( )A、①② B、②④ C、②③ D、①④10. 下列叙述正确的是( )
A、①②④ B、①②③ C、②③④ D、①③④9. 在稀硫酸中加入铜粉,铜粉不溶解,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④KNO3 , 铜粉可溶解的是( )A、①② B、②④ C、②③ D、①④10. 下列叙述正确的是( )①氧化铝是一种比较好的耐火材料,可用来制造耐火坩埚 ②氧化铁常用作红色油漆和涂料 ③硅酸钠是制备硅胶和木材防火剂的原料 ④以纯碱、石灰石、石英为原料可制普通玻璃 ⑤石灰石、高岭石、石英和水晶的主要成分都是SiO2
A、①③④⑤ B、②③④⑤ C、①②④⑤ D、①②③④11. 下列试剂的保存方法错误的是( )A、少量的钠保存在煤油中 B、氢氟酸保存在无色玻璃瓶中 C、氢氧化钠溶液保存在橡皮塞的玻璃瓶中 D、新制的氯水保存在棕色玻璃瓶中12. 将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中铁、铝物质的量之比为( )A、3∶2 B、2∶1 C、3∶4 D、4∶313. 下列各组离子,能在溶液中大量共存的是( )A、Na+、Mg2+、Cl﹣、SO42﹣ B、Na+、Ca2+、CO32﹣、NO3﹣ C、Na+、H+、Cl﹣、CO32﹣ D、K+、Al3+、SO42﹣、OH﹣14. 某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴滴加1mol/L的NaOH溶液至过量,下列关系图正确的是( )A、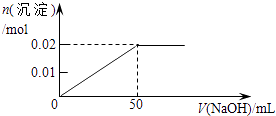 B、
B、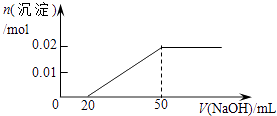 C、
C、 D、
D、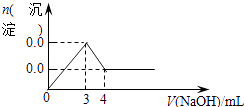 15. 化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是( )A、定性检验SO32- , 将BaCl2溶液用HNO3酸化 B、为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化 C、检验溶液中是否含有Fe2+时,用硝酸酸化 D、检验溶液中是否含有SO42-时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液16. 下列实验用来证明SO2的存在,其中正确的是( )A、能使品红褪色。 B、能使湿润的蓝色石蕊试纸变红。 C、通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸。 D、通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸。17. 在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.3mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为( )A、0.225mol/L B、0.25mol/L C、0.35mol/L D、0.7mol/L18. 用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
15. 化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是( )A、定性检验SO32- , 将BaCl2溶液用HNO3酸化 B、为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化 C、检验溶液中是否含有Fe2+时,用硝酸酸化 D、检验溶液中是否含有SO42-时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液16. 下列实验用来证明SO2的存在,其中正确的是( )A、能使品红褪色。 B、能使湿润的蓝色石蕊试纸变红。 C、通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸。 D、通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸。17. 在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.3mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为( )A、0.225mol/L B、0.25mol/L C、0.35mol/L D、0.7mol/L18. 用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( ) A、A B、B C、C D、D19. 200℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合气体的平均式量为( )
A、A B、B C、C D、D19. 200℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合气体的平均式量为( )
A、5.8 B、11.6 C、23.2 D、46.420. 足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )A、60mL B、45mL C、30mL D、15mL二、综合题
-
21. 在花瓶中插上一束美丽的鲜花,将会给你紧张而又忙碌的学习、生活带来轻松和愉悦的心情。可是过不了几天,花儿就会枯萎。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成 分
质 量(g)
摩尔质量(g/mol)
蔗糖
50.00
342
硫酸钾
0.50
174
阿司匹林
0.35
180
高锰酸钾
0.50
158
硝酸银
0.04
170
(1)、下列“鲜花保鲜剂”的成分中,属于非电解质的是_________(填字母)。A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银(2)、“鲜花保鲜剂”中的K+的物质的量浓度约为(阿司匹林中不含K+)。(3)、配制上述1L“鲜花保鲜剂”所需的仪器有:量筒、烧杯、玻璃棒、托盘天平、药匙、。(填所缺仪器的名称)。(4)、在溶液配制过程中,下列操作对配制结果没有影响的是______(填字母)。A、定容用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切 B、容量瓶在使用前未干燥,里面有少量蒸馏水 C、容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净 D、定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理(5)、实验室用固体加热制氨气的化学反应方程式为:。(6)、若将收集到的氨气溶于水配成100 mL的溶液,所得氨水中NH3物质量浓度(不考虑NH3与H2O的反应)为0.3 mol·L-1 , 则需要氨气的体积为mL(标准状况)。22.(1)、Ⅰ. 有一瓶澄清溶液,可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、Cl―、I―现进行如下实验:①测知溶液显强酸性;②取样加少量CCl4和数滴新制氯水,CCl4层为紫红色;
③另取样滴加稀NaOH溶液,使溶液变为碱性,此过程中均无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿红色石蕊试纸变蓝。
请回答:原溶液中肯定存在的离子是;不能确定是否存在的离子是
(2)、Ⅱ.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: NO3-+ 4H++3e-→NO↑+ 2H2O其中KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
①写出并配平该氧化还原反应的方程式。
②反应中硝酸体现了、性质。
③反应中若产生0.2mol气体,则转移电子的数目是。
④若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是
23. 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下: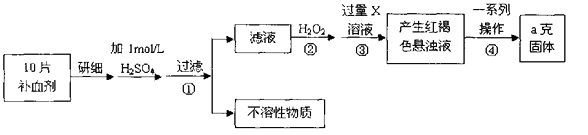
请回答下列问题:
(1)、证明步骤①滤液中含有Fe2+的方法 , 该过程的现象为:(2)、步骤②加入过量H2O2的目的(用离子方程式表示):。(3)、步骤③中反应的离子方程式:。(4)、实际上向滤液中直接滴加X溶液最终也会生成红褐色浊液,此过程中发生的氧化还原反应为(用化学方程式表达)。
(5)、步骤④中最终得到a克红棕色粉末,则一系列处理的操作步骤:、洗涤、、冷却、称量。
(6)、若实验无损耗,则每片补血剂含铁元素的质量g。(7)、正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含mgFeSO4·7H2O的片剂。
三、实验题
-
24. 氯气是一种重要的工业原料。(1)、写出实验室制取氯气反应的化学方程式。(2)、资料显示:Ca(ClO)2 +CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。

①在该实验中,甲部分的装置是(填字母)。

②乙装置中FeCl2溶液与Cl2反应的离子方程式是。
③丙装置中通入少量Cl2 , 可制得某种生活中常用的漂白、消毒的物质,这种物质是(化学式)。
④有人认为该实验存在明显的缺陷,请你将认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂。
请你写出Cl2和“④”中“最合适的化学试剂”反应的离子方程式。