吉林松原油田高中2015-2016学年高一下学期化学开学考试试卷
试卷日期:2018-02-08 考试类型:开学考试
一、单选题
-
1. 下列有关化学实验安全问题的叙述中不正确的是( )A、少量的浓硫酸沾到皮肤上时,可以直接用大量的水冲洗 B、取用化学药品时,应特别注意观察药品包装上的安全警示标记 C、凡是给玻璃仪器加热时,都要加垫石棉网,以防仪器炸裂 D、闻任何化学药品的气味都不能使鼻子凑近药品2. 用下列实验装置进行相应实验,能达到实验目的是( )
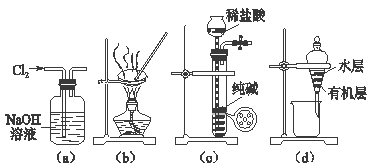 A、用图(a)所示装置除去Cl2中含有的少量HCl B、用图(b)所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 C、用图(c)所示装置制取少量纯净的CO2气体 D、用图(d)所示装置分离CCl4萃取碘水后已分层的有机层和水层3. 下列各组数据中,前者刚好是后者两倍的是( )A、2mol水的摩尔质量和1mol水的摩尔质量 B、200mL1mol/L氯化钙溶液中c(Cl-)和100mL2mol/L氯化钾溶液中c(Cl-) C、64g二氧化硫中氧原子数和标准状况下22.4L一氧化碳中氧原子数 D、20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度4. 在容量瓶的使用方法中,下列操作中正确的是( )A、容量瓶用蒸馏水洗净后,再用待配液润洗 B、使用容量瓶前检查它是否漏水 C、配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线2-3cm处,用滴管滴加蒸馏水到刻度线 D、配制溶液时,如果试样是液体,用量筒量取试样后直接到入容量瓶中,缓慢加入蒸馏水到接近刻度线2-3cm处,用滴管加蒸馏水到刻度线5. 需经过称量、溶解、转移、定容等操作.下列图示对应的操作规范的是( )A、
A、用图(a)所示装置除去Cl2中含有的少量HCl B、用图(b)所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 C、用图(c)所示装置制取少量纯净的CO2气体 D、用图(d)所示装置分离CCl4萃取碘水后已分层的有机层和水层3. 下列各组数据中,前者刚好是后者两倍的是( )A、2mol水的摩尔质量和1mol水的摩尔质量 B、200mL1mol/L氯化钙溶液中c(Cl-)和100mL2mol/L氯化钾溶液中c(Cl-) C、64g二氧化硫中氧原子数和标准状况下22.4L一氧化碳中氧原子数 D、20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度4. 在容量瓶的使用方法中,下列操作中正确的是( )A、容量瓶用蒸馏水洗净后,再用待配液润洗 B、使用容量瓶前检查它是否漏水 C、配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线2-3cm处,用滴管滴加蒸馏水到刻度线 D、配制溶液时,如果试样是液体,用量筒量取试样后直接到入容量瓶中,缓慢加入蒸馏水到接近刻度线2-3cm处,用滴管加蒸馏水到刻度线5. 需经过称量、溶解、转移、定容等操作.下列图示对应的操作规范的是( )A、 称量
B、
称量
B、 溶解
C、
溶解
C、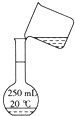 转移
D、
转移
D、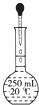 定容
6. 下列物质的分类结果全部正确的是( )A、NO2——酸性氧化物 Na2O2——碱性氧化物 Al2O3——两性氧化物 B、汽油——混合物 胆矾——纯净物 H2——单质 C、苏打——碱 硫化氢——酸 小苏打——酸式盐 D、液氯——非电解质 硫酸钡——强电解质7. 下列物质在水溶液中的电离方程式错误的是( )A、NaHCO3═Na++H++CO32- B、NaHSO4═Na++H++SO42- C、MgCl2═Mg2++2Cl- D、Ba(OH)2═Ba2++2OH-8. 下列说法正确的是( )A、氧化还原反应的本质是元素化合价的升降 B、氧化还原反应一定有氧元素参加 C、氧化反应一定先于还原反应 D、发生氧化反应的物质也可能同时发生还原反应9. 将足量CO2气体通入水玻璃中,然后加热蒸干,再在高温下充分燃烧,最后所得的固体物质是( )A、硅酸钠 B、碳酸钠,硅酸钠 C、碳酸钠,二氧化硅 D、二氧化硅10. 如图,某兴趣小组设计如下装置进行氯气与金属钠的反应,先将钠预热,待钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是( )
定容
6. 下列物质的分类结果全部正确的是( )A、NO2——酸性氧化物 Na2O2——碱性氧化物 Al2O3——两性氧化物 B、汽油——混合物 胆矾——纯净物 H2——单质 C、苏打——碱 硫化氢——酸 小苏打——酸式盐 D、液氯——非电解质 硫酸钡——强电解质7. 下列物质在水溶液中的电离方程式错误的是( )A、NaHCO3═Na++H++CO32- B、NaHSO4═Na++H++SO42- C、MgCl2═Mg2++2Cl- D、Ba(OH)2═Ba2++2OH-8. 下列说法正确的是( )A、氧化还原反应的本质是元素化合价的升降 B、氧化还原反应一定有氧元素参加 C、氧化反应一定先于还原反应 D、发生氧化反应的物质也可能同时发生还原反应9. 将足量CO2气体通入水玻璃中,然后加热蒸干,再在高温下充分燃烧,最后所得的固体物质是( )A、硅酸钠 B、碳酸钠,硅酸钠 C、碳酸钠,二氧化硅 D、二氧化硅10. 如图,某兴趣小组设计如下装置进行氯气与金属钠的反应,先将钠预热,待钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是( )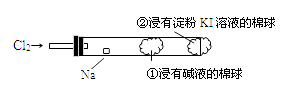 A、钠着火剧烈燃烧产生黄色的火焰 B、反应产生的大量白烟是氯化钠固体 C、棉球①的作用是吸收过量氯气防止产生污染 D、棉球②变蓝色则证明氯气已被碱液完全吸收11. 滴加新制氯水后,下列各组离子可能大量存在的是( )A、Fe3+、Al3+、Cl-、NO3- B、K+、Na+、I-、SO42- C、Ag+、Ca2+、NH4+、NO3- D、Na+、Ba2+、CO32-、SO42-12. 在铜的冶炼过程中有如下反应发生:5FeS2+14CuSO4+12H2O=7Cu2S+5FeSO4+12H2SO4 , 关于此反应,下列说明正确的是( )A、Cu2S既是氧化产物,又是还原产物 B、5 mol FeS2发生反应,有10mol电子转移 C、产物中的SO42-有一部分是氧化产物 D、FeS2只作还原剂13. 下列关于合金的叙述中正确的是( )A、合金是由两种或多种金属熔合而成的 B、日常生活中用到的五角硬币属于铜合金 C、合金在任何情况都比单一金属性能优良 D、商代的司母戊鼎是纯铜打造而成的14. 下面有关氯气的叙述正确的是( )A、氯气可使湿润的红布条褪色,所以氯气具有漂白性 B、在通常情况下,氯气可以和任何金属直接化合 C、氯气没有漂白性,但通入品红溶液中,品红会褪色 D、氯气是黄绿色气体,闻其气味时要小心将集气瓶放在鼻孔下直接闻15. 为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是( )A、推广使用燃煤脱硫技术,防治SO2 污染 B、加大石油、煤炭的开采力度,增加化石燃料的供应量 C、研制开发燃料电池汽车,减少机动车尾气污染 D、实施绿化工程,防治扬尘污染16. G、Q、X、Y、Z均为含氯的化合物,在一定条件下具有如下转化关系
A、钠着火剧烈燃烧产生黄色的火焰 B、反应产生的大量白烟是氯化钠固体 C、棉球①的作用是吸收过量氯气防止产生污染 D、棉球②变蓝色则证明氯气已被碱液完全吸收11. 滴加新制氯水后,下列各组离子可能大量存在的是( )A、Fe3+、Al3+、Cl-、NO3- B、K+、Na+、I-、SO42- C、Ag+、Ca2+、NH4+、NO3- D、Na+、Ba2+、CO32-、SO42-12. 在铜的冶炼过程中有如下反应发生:5FeS2+14CuSO4+12H2O=7Cu2S+5FeSO4+12H2SO4 , 关于此反应,下列说明正确的是( )A、Cu2S既是氧化产物,又是还原产物 B、5 mol FeS2发生反应,有10mol电子转移 C、产物中的SO42-有一部分是氧化产物 D、FeS2只作还原剂13. 下列关于合金的叙述中正确的是( )A、合金是由两种或多种金属熔合而成的 B、日常生活中用到的五角硬币属于铜合金 C、合金在任何情况都比单一金属性能优良 D、商代的司母戊鼎是纯铜打造而成的14. 下面有关氯气的叙述正确的是( )A、氯气可使湿润的红布条褪色,所以氯气具有漂白性 B、在通常情况下,氯气可以和任何金属直接化合 C、氯气没有漂白性,但通入品红溶液中,品红会褪色 D、氯气是黄绿色气体,闻其气味时要小心将集气瓶放在鼻孔下直接闻15. 为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是( )A、推广使用燃煤脱硫技术,防治SO2 污染 B、加大石油、煤炭的开采力度,增加化石燃料的供应量 C、研制开发燃料电池汽车,减少机动车尾气污染 D、实施绿化工程,防治扬尘污染16. G、Q、X、Y、Z均为含氯的化合物,在一定条件下具有如下转化关系A.G→Q+NaCl
B.Q+H2O→X+H2↑
C.Y+NaOH→G+Q+HO
D.Z+NaOH→Q+X+H2O
判断氯的化合价由低到高的排列顺序( )
A、X Y Z G Q B、Y X Z G Q C、G Y Q Z X D、X Z Q Y G17. 下列各组物质相互作用时,生成物不随反应条件或反应物的量变化而变化的是( )A、Na和O2 B、NaOH和CO2 C、NaHCO3和NaOH D、Na2CO3和HCl18. 向物质的量浓度均为1mol/L的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,如图中[n表示Al(OH)3的物质的量、V表示NaOH溶液的体积]能正确表示这个反应过程的是( )A、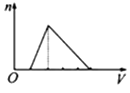 B、
B、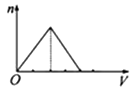 C、
C、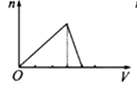 D、
D、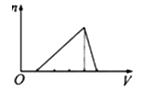 19. 某溶液能与Al粉反应放出H2 , 该溶液中可能大量共存的离子组是( )A、NH4+、Ba2+、HCO3-、Cl- B、K+、Al3+、S2-、ClO- C、Na+、Fe3+、Cl-、SO42- D、H+、Mg2+、SO42-、NO3-20. 某溶液中可能存在Mg2+、Fe2+、Fe3+ , 加入NaOH 溶液,开始有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是( )A、一定有Fe2+ , 一定没有Mg2+、Fe3+ B、一定有Fe3+ , 一定没有Mg2+、Fe2+ C、一定有Fe3+ , 可能有Fe2+ , 一定没有Mg2+ D、一定有Fe2+ , 可能有Mg2+ , 一定没有Fe3+21. 将22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3molNO2和0.2molNO,下列说法正确的是( )A、反应后生成的盐只有Fe(NO3)3 B、反应后生成的盐只有Fe(NO3)2 C、反应后生成的盐为Fe(NO3)2和Fe(NO3)3 , 其物质的量之比为1:3 D、反应后生成的盐为Fe(NO3)2和Fe(NO3)3 , 其物质的量之比为3:122. 用一定量的铁与足量的稀硫酸及足量的CuO制单质铜,有人设计了以下两种方案:
19. 某溶液能与Al粉反应放出H2 , 该溶液中可能大量共存的离子组是( )A、NH4+、Ba2+、HCO3-、Cl- B、K+、Al3+、S2-、ClO- C、Na+、Fe3+、Cl-、SO42- D、H+、Mg2+、SO42-、NO3-20. 某溶液中可能存在Mg2+、Fe2+、Fe3+ , 加入NaOH 溶液,开始有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是( )A、一定有Fe2+ , 一定没有Mg2+、Fe3+ B、一定有Fe3+ , 一定没有Mg2+、Fe2+ C、一定有Fe3+ , 可能有Fe2+ , 一定没有Mg2+ D、一定有Fe2+ , 可能有Mg2+ , 一定没有Fe3+21. 将22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3molNO2和0.2molNO,下列说法正确的是( )A、反应后生成的盐只有Fe(NO3)3 B、反应后生成的盐只有Fe(NO3)2 C、反应后生成的盐为Fe(NO3)2和Fe(NO3)3 , 其物质的量之比为1:3 D、反应后生成的盐为Fe(NO3)2和Fe(NO3)3 , 其物质的量之比为3:122. 用一定量的铁与足量的稀硫酸及足量的CuO制单质铜,有人设计了以下两种方案:①
 ②
② 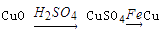
则两种方案制得单质铜的量为( )
A、①多 B、②多 C、相等 D、无法判断23. 部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:
下列说法正确的是( )
A、滤液A中的阳离子为Fe2+、Fe3+、H+ B、样品中Fe元素的质量为2.24g C、样品中CuO的质量为4.0g D、V=89624. 将0.4 g NaOH和1.06 gNa2CO3混合并配成溶液,向溶液中滴加0.1 mol/L稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系是( )A、 B、
B、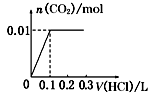 C、
C、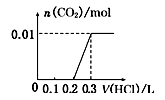 D、
D、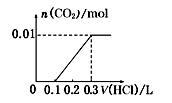 25. 无色的混合气体甲,可能含有NO、CO2、NO2、NH3、N2中的某几种。将100mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为( )
25. 无色的混合气体甲,可能含有NO、CO2、NO2、NH3、N2中的某几种。将100mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为( )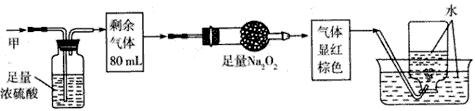 A、NH3、NO2、N2 B、NH3、NO2、CO2 C、NH3、NO、CO2 D、NO、CO2、N2
A、NH3、NO2、N2 B、NH3、NO2、CO2 C、NH3、NO、CO2 D、NO、CO2、N2二、实验题
-
26. 海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下图:
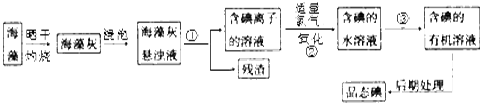 (1)、指出从海藻中提取I2的实验操作名称:① , ③;②的离子方程式。(2)、提取碘的过程中,可供选择的有机溶剂是__________。A、苯、酒精 B、四氯化碳、苯 C、汽油、醋酸(3)、为使海藻中I-转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器。尚缺少的仪器是。(4)、从含碘的有机溶剂中提取碘,还要经过蒸馏,指出下列蒸馏装置中的错误之处。
(1)、指出从海藻中提取I2的实验操作名称:① , ③;②的离子方程式。(2)、提取碘的过程中,可供选择的有机溶剂是__________。A、苯、酒精 B、四氯化碳、苯 C、汽油、醋酸(3)、为使海藻中I-转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器。尚缺少的仪器是。(4)、从含碘的有机溶剂中提取碘,还要经过蒸馏,指出下列蒸馏装置中的错误之处。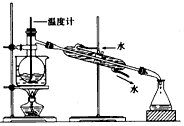 27. 二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.(1)、工业上用黄铁矿(FeS2 , 其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2 + 11O2 8SO2 + 2Fe2O3 , 该反应中被氧化的元素是(填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为L.(2)、实验室中用如图1所示的装置测定SO2催化氧化为SO3 , 的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响.)
27. 二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.(1)、工业上用黄铁矿(FeS2 , 其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2 + 11O2 8SO2 + 2Fe2O3 , 该反应中被氧化的元素是(填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为L.(2)、实验室中用如图1所示的装置测定SO2催化氧化为SO3 , 的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响.)
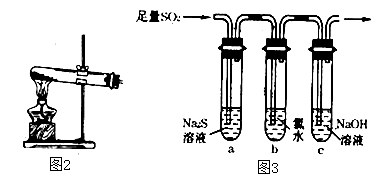
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 .
②实验过程中,需要通入氧气.试写出一个用图2所示装置制取氧气的化学方程式 .
③当停止通入SO2 , 熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 .
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是(用含字母的代数式表示,不用化简)。
(3)、某学习小组设计用如图3装置验证二氧化硫的化学性质.①能说明二氧化硫具有氧化性的实验现象为 .
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是(填“I”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 .
三、填空题
-
28. 下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。请根据此表 ;
结合中学学过的化学知识,回答下列问题:
配料表
精制海盐、碘酸钾(KIO3)
含碘量
20-40mg/kg
储藏方法
密封避光、防潮
食用方法
烹调时待食品熟后加入碘盐
(1)、据物质分类中的树状分类法有关知识,在①HIO3 ②碘酸钠 ③KOH ④I2O5 ⑤NaCl五种(填“混合物”或“化合物”或“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的有 。(填序号)(2)、推测出碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)溶于水(填“能”或“不能”),化学性质:碘酸钾(KIO3)在高温受热时(填“易”或“难”)分解。四、推断题
-
29. 根据下列转化关系,回答有关问题。
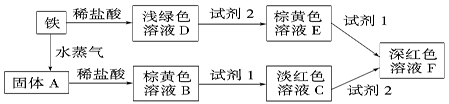 (1)、浅绿色溶液D主要成分的化学式为 , 试剂1是。(2)、下列物质不能作为试剂2的是(填序号)。
(1)、浅绿色溶液D主要成分的化学式为 , 试剂1是。(2)、下列物质不能作为试剂2的是(填序号)。a.Cl2 b.新制氯水 c.浓硫酸 d.S e.硝酸
(3)、固体A溶于稀盐酸的化学方程式(4)、溶液C到溶液F红色加深的原因是30. 下图表示有关的一种反应物或生成物(无关物质已略去),其中A、C为无色气体,请填写下列空白。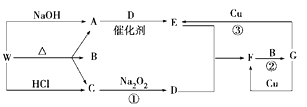 (1)、化合物W可能是或 , C是 , F是。(2)、反应①中若消耗Na2O2 7.8 g,则转移的电子数为。(3)、反应③的离子方程式:。(4)、A与CuO在加热条件下能反应生成N2和Cu,请写出该反应的化学方程式: 。
(1)、化合物W可能是或 , C是 , F是。(2)、反应①中若消耗Na2O2 7.8 g,则转移的电子数为。(3)、反应③的离子方程式:。(4)、A与CuO在加热条件下能反应生成N2和Cu,请写出该反应的化学方程式: 。
-