江苏省扬州市江都区2016-2017学年九年级上学期化学期末考试试卷
试卷日期:2018-01-09 考试类型:期末考试
一、单选题
-
1. “低碳”是一种生活理念,也是一种生活态度。下列做法中不符合“低碳”要求的是( )A、提倡骑自行车、乘公交车出行 B、优化建筑设计,减少空调使用 C、多挖煤、多发电,加快经济发展 D、少用一次性餐具、塑料袋2. 下列成语中不包含化学变化的是( )A、百炼成钢 B、滴水成冰 C、死灰复燃 D、火烧连营3. 下列常见物质中属于纯净物的是( )A、大理石 B、加碘盐 C、结冰的蒸馏水 D、空气4. 由离子构成的物质是( )A、硅 B、氯化钠 C、氧气 D、金刚石5. 每100g黑木耳中含铁185mg,是常见天然食品中最高的,这里的“铁”应理解为( )A、分子 B、原子 C、元素 D、离子6. 下列实验操作正确的是( )A、测定溶液酸碱度
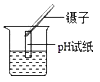 B、收集二氧化碳
B、收集二氧化碳  C、倾倒液体
C、倾倒液体 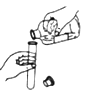 D、熄灭酒精灯
D、熄灭酒精灯 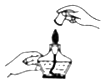 7. 亚硝酸钠(NaNO₂)是一种工业盐,有毒可致癌,常在非法食品制作时用作食盐的不合理替代品。其中氮元素的化合价是( )A、+5 B、-3 C、+3 D、+48. 下列实验现象描述正确的是( )A、镁与足量稀盐酸反应放热,有气泡产生,固体消失 B、硫在氧气中燃烧,发出蓝紫色火焰,生成二氧化硫 C、稀盐酸中滴入酚酞试液,溶液变为红色 D、红磷在空气中燃烧,产生大量白色烟雾9. 微量元素在人体中起着极其重要的作用,下列属于人体所需的微量元素是( )A、O B、Cu C、C D、Ca10. 下列关于溶液的说法正确的是( )A、溶液是无色透明的 B、均一稳定的液体就是溶液 C、澄清石灰水的溶质是氧化钙 D、碘酒中的溶剂是酒精11. 人体内几种体液的正常pH范围如下,其中酸性最强的是( )A、血液 7.35~7.45 B、胃液 0.8~1.5 C、唾液 6.6~7.1 D、胆汁 6.8~7.412. 铜在潮湿空气中易生锈变成铜绿【Cu2(OH)2CO3】,空气中不参与此过程的物质是( )A、氧气 B、水蒸气 C、氮气 D、二氧化碳13. 下列有关生活常识的说法中,不正确的是( )A、发现家里煤气泄露时,立即打开排气扇 B、硫酸铜溶液不能用铁质容器盛放 C、家用铝锅不宜用铁丝球用力擦洗 D、实行垃圾分类回收,既节约资源,又保护环境14. 中国传统饮料茶中含有的茶多酚具有解毒和抗辐射的作用,其化学式为C17H19N3O。对于茶多酚下列说法正确的是( )A、茶多酚由17个碳原子、19个氢原子、3个氮原子和1个氧原子构成 B、茶多酚里含有4种元素 C、茶多酚中氢元素质量分数最小 D、茶多酚中碳、氢、氮、氧元素质量比为17:19:3:115. 下列所示的图像能反映相对应实验的是( )A、向pH=12的石灰水中不断加水稀释
7. 亚硝酸钠(NaNO₂)是一种工业盐,有毒可致癌,常在非法食品制作时用作食盐的不合理替代品。其中氮元素的化合价是( )A、+5 B、-3 C、+3 D、+48. 下列实验现象描述正确的是( )A、镁与足量稀盐酸反应放热,有气泡产生,固体消失 B、硫在氧气中燃烧,发出蓝紫色火焰,生成二氧化硫 C、稀盐酸中滴入酚酞试液,溶液变为红色 D、红磷在空气中燃烧,产生大量白色烟雾9. 微量元素在人体中起着极其重要的作用,下列属于人体所需的微量元素是( )A、O B、Cu C、C D、Ca10. 下列关于溶液的说法正确的是( )A、溶液是无色透明的 B、均一稳定的液体就是溶液 C、澄清石灰水的溶质是氧化钙 D、碘酒中的溶剂是酒精11. 人体内几种体液的正常pH范围如下,其中酸性最强的是( )A、血液 7.35~7.45 B、胃液 0.8~1.5 C、唾液 6.6~7.1 D、胆汁 6.8~7.412. 铜在潮湿空气中易生锈变成铜绿【Cu2(OH)2CO3】,空气中不参与此过程的物质是( )A、氧气 B、水蒸气 C、氮气 D、二氧化碳13. 下列有关生活常识的说法中,不正确的是( )A、发现家里煤气泄露时,立即打开排气扇 B、硫酸铜溶液不能用铁质容器盛放 C、家用铝锅不宜用铁丝球用力擦洗 D、实行垃圾分类回收,既节约资源,又保护环境14. 中国传统饮料茶中含有的茶多酚具有解毒和抗辐射的作用,其化学式为C17H19N3O。对于茶多酚下列说法正确的是( )A、茶多酚由17个碳原子、19个氢原子、3个氮原子和1个氧原子构成 B、茶多酚里含有4种元素 C、茶多酚中氢元素质量分数最小 D、茶多酚中碳、氢、氮、氧元素质量比为17:19:3:115. 下列所示的图像能反映相对应实验的是( )A、向pH=12的石灰水中不断加水稀释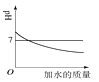 B、向碳酸钙固体中逐滴加入稀盐酸至过量
B、向碳酸钙固体中逐滴加入稀盐酸至过量 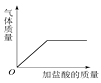 C、在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
C、在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出 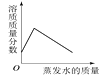 D、将足量的金属镁和锌分别和质量相等、相同质量分数的稀硫酸混合
D、将足量的金属镁和锌分别和质量相等、相同质量分数的稀硫酸混合 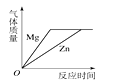 16. 下表中,除去物质所含杂质的方法正确的是( )
16. 下表中,除去物质所含杂质的方法正确的是( )物 质
所含杂质
除去杂质的方法
A
CO2
CO
通入氧气点燃
B
Cu粉
C粉
在空气中灼烧
C
NaCl
KNO3
冷却热饱和溶液结晶
D
CaCl2溶液
HCl
加过量CaCO3粉末,过滤
A、A B、B C、C D、D17. 下图是甲、乙、丙三种固体物质的溶解度曲线。则有关叙述正确的是( ) A、t1℃时,等质量的甲、乙饱和溶液中所含溶质的质量为乙>甲 B、t2℃时,20g丙能溶解于50g水中形成70g溶液 C、若要将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法 D、t3℃时,将甲、乙、丙三种物质的饱和溶液降温到t2℃,所得溶液溶质质量分数的大小关系为:乙>甲=丙18. 已知反应前后分子变化的微观示意图如下所示。下列说法正确的是( )
A、t1℃时,等质量的甲、乙饱和溶液中所含溶质的质量为乙>甲 B、t2℃时,20g丙能溶解于50g水中形成70g溶液 C、若要将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法 D、t3℃时,将甲、乙、丙三种物质的饱和溶液降温到t2℃,所得溶液溶质质量分数的大小关系为:乙>甲=丙18. 已知反应前后分子变化的微观示意图如下所示。下列说法正确的是( ) A、此反应中有三种氧化物 B、此反应中反应物的质量比是1:2 C、该反应是置换反应 D、反应前后原子的种类和个数都不变19. 将氯酸钾和二氧化锰的混合物30克置于试管中,加热一段时间后冷却称量剩余固体为20.4克。将此剩余固体加入足量水充分溶解(二氧化锰不溶于水)后过滤,滤渣经洗涤干燥后称得质量为5克。下列说法正确的是( )A、参加反应的氯酸钾质量为25克 B、停止加热后剩余固体中含有两种物质 C、生成氧气质量为9.6克 D、反应过程中固体中二氧化锰的质量分数不变20. 下列说法正确的是( )A、二氧化碳有毒,不能供给呼吸 B、合金中一定不含非金属元素 C、植物的光合作用是空气中氧气的主要来源 D、原子的质量主要集中在原子核上
A、此反应中有三种氧化物 B、此反应中反应物的质量比是1:2 C、该反应是置换反应 D、反应前后原子的种类和个数都不变19. 将氯酸钾和二氧化锰的混合物30克置于试管中,加热一段时间后冷却称量剩余固体为20.4克。将此剩余固体加入足量水充分溶解(二氧化锰不溶于水)后过滤,滤渣经洗涤干燥后称得质量为5克。下列说法正确的是( )A、参加反应的氯酸钾质量为25克 B、停止加热后剩余固体中含有两种物质 C、生成氧气质量为9.6克 D、反应过程中固体中二氧化锰的质量分数不变20. 下列说法正确的是( )A、二氧化碳有毒,不能供给呼吸 B、合金中一定不含非金属元素 C、植物的光合作用是空气中氧气的主要来源 D、原子的质量主要集中在原子核上二、填空题
-
21. 用化学用语填空:
①保持氮气化学性质的微粒; ②n个铜离子;
③氦气; ④缺乏元素易得佝偻病;
⑤氢气中氢元素的化合价; ⑥人体中最多的物质
22. 选择适当的物质,用序号填空:A.不锈钢 B. 氯化钠 C.二氧化碳 D.铜 E.氮气
(1)、光合作用的原料之一;(2)、填充在食品包装袋里做保护气的物质 ;(3)、一种耐腐蚀的合金;(4)、常用来制电线、电缆的紫红色金属 ;(5)、生理盐水的溶质。三、简答题
-
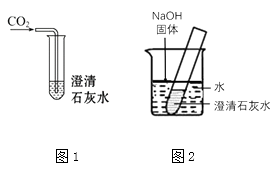
23. 水和溶液在生产、生活中起着十分重要的作用。(1)、走近臭水沟就闻到臭味,请用微粒的观点解释 。为了除去水的臭味和颜色,可以用 进行吸附。(2)、检验水是硬水还是软水可用的物质是 。硬水中含有较多(填离子符号),生活中将硬水软化常用的方法是 。使用久的水壶内壁会形成水垢,可用厨房中的 浸泡除去。(3)、我们常在水中加洗洁精清洗餐具上的油污,这是因为洗洁精具有作用。(4)、水可以用于灭火,其原理是。(5)、电解水时电源负极产生的气体是(填化学式),正极和负极产生气体的体积比为 , 其反应的化学方程式。(6)、冬季常在积雪上撒盐,目的是。(7)、高温下,铁能和水蒸气反应生成四氧化三铁和一种可燃的气体单质,该反应的化学方程式为。(8)、下图1是将CO2通入澄清石灰水,图2中往烧杯里加入氢氧化钠固体,两只试管中澄清石灰水都变浑浊。图1中石灰水变浑浊的化学方程式是 ,图2中石灰水变浑浊的原因是。
 24. 日常使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所包围,总称为"碳包"。碳包和锌筒之间填充着氯化铵、氯化锌的水溶液和淀粉等组成的糊状物。废旧干电池随意丢弃会造成环境污染。学校兴趣小组同学准备对废旧的干电池进行探究。
24. 日常使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所包围,总称为"碳包"。碳包和锌筒之间填充着氯化铵、氯化锌的水溶液和淀粉等组成的糊状物。废旧干电池随意丢弃会造成环境污染。学校兴趣小组同学准备对废旧的干电池进行探究。(一)拆解干电池,得到铜帽、锌皮、碳棒、黑色粉末等物质。
(二)回收二氧化锰并测定碳粉与二氧化锰的质量比:
 (1)、干电池使用时将化学能转化成能。(2)、上述操作中灼烧的目的是;(3)、同学们将过滤后得到的滤渣干燥后称得质量为25克,充分灼烧后冷却称得剩余固体质量为20克,则滤渣中二氧化锰与碳粉的质量比为。经分析,此结果偏大,老师指出同学们在实验中缺少一步操作,该操作是。(4)、为验证二氧化锰,同学们用A、B两支洁净试管,分别取5毫升3%的过氧化氢溶液,往A试管中加入少量上述实验灼烧后得到的固体,如果出现的现象,说明为二氧化锰。反应的化学方程式为。(5)、(三)用拆解得到的锌皮(含杂质)制取硫酸锌晶体。
(1)、干电池使用时将化学能转化成能。(2)、上述操作中灼烧的目的是;(3)、同学们将过滤后得到的滤渣干燥后称得质量为25克,充分灼烧后冷却称得剩余固体质量为20克,则滤渣中二氧化锰与碳粉的质量比为。经分析,此结果偏大,老师指出同学们在实验中缺少一步操作,该操作是。(4)、为验证二氧化锰,同学们用A、B两支洁净试管,分别取5毫升3%的过氧化氢溶液,往A试管中加入少量上述实验灼烧后得到的固体,如果出现的现象,说明为二氧化锰。反应的化学方程式为。(5)、(三)用拆解得到的锌皮(含杂质)制取硫酸锌晶体。实验步骤:①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应;②将上述反应后的混合物过滤。③将滤液加热浓缩、、过滤,得到ZnSO4·7H2O晶体。
(6)、步骤①中反应方程式为 , 将锌皮剪碎的目的是。(7)、步骤②需要的仪器有铁架台、烧杯、和玻璃棒,玻璃棒的作用是。(8)、步骤③缺少的操作是。(9)、(四)测定锌皮中锌的质量分数。同学们设计了如下实验装置,取1克锌皮放于试管中,实验中将注射器内50毫升稀硫酸(足量)完全注入试管中。当试管中不再产生气泡时立刻读数得到量筒中水的体积为350毫升。已知实验条件下氢气的密度为0.09g/L。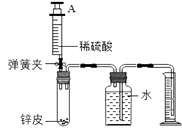
计算该锌皮中锌的质量分数。(写出计算过程,结果保留两位小数)
(10)、上述方法测得的锌的质量分数偏大,不可能的原因是____________A、没等装置冷却就读数 B、锌皮中含有少量铁 C、试管中有气体没有排出 D、将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹四、实验探究题
-
25. 实验室利用下图所示装置进行相关实验,请回答问题。
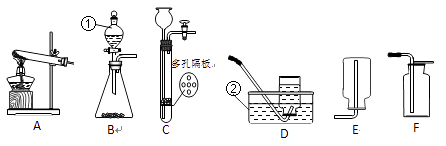 (1)、写出装置图中标号仪器的名称:① , ②。(2)、用高锰酸钾制氧气,应选用发生装置是(填字母),反应的化学方程式为 , 该反应中转化为氧气的氧元素占高锰酸钾中总的氧元素的质量分数是 , 二氧化锰(填“是”或“不是”)该反应的催化剂。(3)、实验室制取二氧化碳反应的化学方程式为。二氧化碳也可用碳酸氢钠(NaHCO3)固体加热分解(产物为碳酸钠、二氧化碳和水)来获取,该反应的化学方程式为:;若用此法来制取CO2 , 应选用的发生装置是(填序号)。(4)、常温下,用锌和稀硫酸反应制取氢气,若要控制反应的发生和停止,应选用的发生装置是(填序号),氢气在点燃前必须先验纯,为确保安全,验纯氢气时最好用法收集氢气。如果用过氧化氢溶液和二氧化锰粉末制取氧气,(填“能”或“不能”)选择相同的发生装置并控制反应的发生和停止,理由是。26. 某研究小组利用下图所示装置进行探究实验。已知:①碳酸镁加热分解MgCO3 MgO + CO2↑②氢氧化钠溶液常用于吸收二氧化碳气体
(1)、写出装置图中标号仪器的名称:① , ②。(2)、用高锰酸钾制氧气,应选用发生装置是(填字母),反应的化学方程式为 , 该反应中转化为氧气的氧元素占高锰酸钾中总的氧元素的质量分数是 , 二氧化锰(填“是”或“不是”)该反应的催化剂。(3)、实验室制取二氧化碳反应的化学方程式为。二氧化碳也可用碳酸氢钠(NaHCO3)固体加热分解(产物为碳酸钠、二氧化碳和水)来获取,该反应的化学方程式为:;若用此法来制取CO2 , 应选用的发生装置是(填序号)。(4)、常温下,用锌和稀硫酸反应制取氢气,若要控制反应的发生和停止,应选用的发生装置是(填序号),氢气在点燃前必须先验纯,为确保安全,验纯氢气时最好用法收集氢气。如果用过氧化氢溶液和二氧化锰粉末制取氧气,(填“能”或“不能”)选择相同的发生装置并控制反应的发生和停止,理由是。26. 某研究小组利用下图所示装置进行探究实验。已知:①碳酸镁加热分解MgCO3 MgO + CO2↑②氢氧化钠溶液常用于吸收二氧化碳气体 (1)、装置B中发生的反应(用化学方程式表示)。(2)、装置C中盛有足量的氢氧化钠溶液,它的作用。(3)、装置D中无水氯化钙的作用。(4)、装置E中发生的反应(用化学方程式表示)。(5)、从环保角度看,该装置有明显不足之处是。(6)、图中装置F是安全瓶,能防倒吸,从实验安全角度考虑,本实验还应该在装置之间添加装置F。
(1)、装置B中发生的反应(用化学方程式表示)。(2)、装置C中盛有足量的氢氧化钠溶液,它的作用。(3)、装置D中无水氯化钙的作用。(4)、装置E中发生的反应(用化学方程式表示)。(5)、从环保角度看,该装置有明显不足之处是。(6)、图中装置F是安全瓶,能防倒吸,从实验安全角度考虑,本实验还应该在装置之间添加装置F。