江苏省常州市2016-2017学年九年级上学期化学期末考试试卷
试卷日期:2018-01-09 考试类型:期末考试
一、单选题
-
1. 臭氧是一种高效的消毒剂,臭氧(O3)属于( )A、单质 B、氧化物 C、化合物 D、稀有气体2. 化学反应前后一定改变的是( )A、物质种类 B、原子数目 C、分子数目 D、元素种类3. 下列仪器通常可以用酒精灯直接加热的是。( )A、烧杯 B、蒸发皿 C、锥形瓶 D、集气瓶4. 下列家庭实验中属于物理变化的是( )A、用灼烧的方法验证面粉组成用 B、食醋除去水壶中的水垢 C、用擦亮的铝箔在空气中加热 D、用竹炭除去冰箱中的异味。5. 下列做法正确的是( )A、用废旧电池随便丢弃 B、碳酸氢铵化肥敞口放置 C、高层着火后乘电梯下楼 D、外出时关闭燃气阀门6. 下列有关高锰酸钾制氧气,并用排水法收集错误的是( )A、先检查装置气密性后装药品 B、先在试管口放蓬松的棉花后塞紧橡皮塞 C、先将导管放入集气瓶中后加热 D、实验结束时先移导管后熄灭酒精灯7. 下列做法正确的是( )A、氯化钠由氯化钠分子构成 B、10mL酒精与10mL水混合后得到20mL液体 C、一氧化碳和二氧化碳在一定条件下可相互转化 D、金刚石和与石墨碳原子排列方式不同,导致化学性质不同8. 下列对实验现象的观察和记录正确的是( )A、电解水实验中正负极产生的气体体积之比是2:1 B、室温下向饱和食盐水中加入少量硝酸钾固体,搅拌,固体溶解 C、向蒸馏水中滴入2~3滴植物油,搅拌,植物油完全溶解 D、一般情况下,铁丝能在空气中燃烧,火星四射。9. “宏观与微观相结合”是研究化学反应的重要思想。下列说法正确的是( )
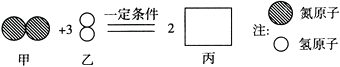 A、该反应中分子和原子种类均改变 B、物质丙的化学式为NH3 C、参加反应的甲、乙质量比为1:3 D、图示反应为分解反应10. 下列有关化学史的说法中正确的是( )A、汤姆生发现电子 B、卢瑟福提出原子的核式结构模型 C、拉瓦锡发现氧气约占空气的1/5体积 D、波义耳提出质量守恒定律11. 下列物质不属于合金的是( )A、黄铜矿 B、生铁 C、不锈钢 D、黄铜12. 下列情况中铁最不容易生锈的是( )A、在干燥、致密、不透气的土壤中 B、在潮湿疏松通气的土壤中 C、在潮湿疏松透气的酸性土壤中 D、在潮湿的盐碱地里。13. 铁和铜是两种常见的金属下列比较中错误的是( )A、都具有良好的导电、导热性 B、都能与氧气发生氧化反应 C、都能与稀硫酸反应 D、铁能置换出铜而铜不能置换出铁14. 向200g溶质质量分数为10%的蔗糖溶液中加入200g水,搅拌后把所得溶液倒掉一半后,剩余的溶液溶质质量分数为( )A、10% B、5% C、2.5% D、0.5%15. 高铁酸钾是一种新型、高效、多功能水处理剂。高铁酸钾与水反应的化学方程式是:4K2FeO4+10H2O=4X↓+8KOH+3O2↑。下列说法错误的是( )A、高铁酸钾中铁显+6价 B、高铁酸钾属于氧化物 C、X的化学式是Fe(OH)3 D、高铁酸钾应密封、防水保存16. 为了探究影响大理石与稀盐酸反应剧烈程度的因素。某学习小组将稀盐酸分成四等份,分别加入四支试管中进行下列实验
A、该反应中分子和原子种类均改变 B、物质丙的化学式为NH3 C、参加反应的甲、乙质量比为1:3 D、图示反应为分解反应10. 下列有关化学史的说法中正确的是( )A、汤姆生发现电子 B、卢瑟福提出原子的核式结构模型 C、拉瓦锡发现氧气约占空气的1/5体积 D、波义耳提出质量守恒定律11. 下列物质不属于合金的是( )A、黄铜矿 B、生铁 C、不锈钢 D、黄铜12. 下列情况中铁最不容易生锈的是( )A、在干燥、致密、不透气的土壤中 B、在潮湿疏松通气的土壤中 C、在潮湿疏松透气的酸性土壤中 D、在潮湿的盐碱地里。13. 铁和铜是两种常见的金属下列比较中错误的是( )A、都具有良好的导电、导热性 B、都能与氧气发生氧化反应 C、都能与稀硫酸反应 D、铁能置换出铜而铜不能置换出铁14. 向200g溶质质量分数为10%的蔗糖溶液中加入200g水,搅拌后把所得溶液倒掉一半后,剩余的溶液溶质质量分数为( )A、10% B、5% C、2.5% D、0.5%15. 高铁酸钾是一种新型、高效、多功能水处理剂。高铁酸钾与水反应的化学方程式是:4K2FeO4+10H2O=4X↓+8KOH+3O2↑。下列说法错误的是( )A、高铁酸钾中铁显+6价 B、高铁酸钾属于氧化物 C、X的化学式是Fe(OH)3 D、高铁酸钾应密封、防水保存16. 为了探究影响大理石与稀盐酸反应剧烈程度的因素。某学习小组将稀盐酸分成四等份,分别加入四支试管中进行下列实验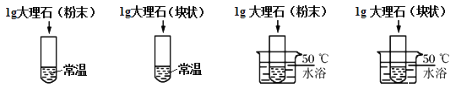
下列对比实验的设计不合理的是( )
选项
对比实验
探究影响因素
A
①和②
反应物的接触面积
B
②和③
温度
C
②和④
温度
D
③和④
反应物的接触面
A、A B、B C、C D、D17. 即热饭盒之所以能加热饭菜,原因是其底部因是装入混有镁、铁粉末的高密度聚乙烯,进行简单的操作后水和镁就会发生剧烈的化学反应,放出热量便可使食物变热,其中铁可能是( )
A、一种反应物 B、起导热作用 C、催化剂 D、增大镁与水分子的接触机会18. 分类方法是化学学习的重要方法,下列分类错误的是( )A、根据纯净物中元素种类数,将其分为单质与化合物 B、根据一定温度下溶液是否再溶解该溶质,将其分为饱和溶液和不饱和溶液 C、根据离子的电性将其分为阳离子与阴离子 D、根据溶质的多少将溶液分为浓溶液和稀溶液。19. 根据图示溶解度曲线,下列结论正确的是( )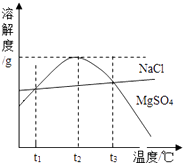 A、NaCl和MgSO4的溶解度仅在t1℃时才相等 B、t2℃时, MgSO4溶液中溶质质量分数一定大于NaCl溶液 C、t2℃时,升温或降温都可将MgSO4不饱和溶液变为饱和溶液 D、t2℃时,蒸发少量水一定可使NaCl晶体从不饱和溶液中析出20. 一氧化碳在高温下还原48g氧化铁,一段时间后,剩余固体质量为46.4g,则剩余固体的成分不可能的情况为( )A、Fe、Fe2O3 B、Fe、FeO C、FeO、Fe2O3 D、Fe、Fe3O4、Fe2O3 、FeO
A、NaCl和MgSO4的溶解度仅在t1℃时才相等 B、t2℃时, MgSO4溶液中溶质质量分数一定大于NaCl溶液 C、t2℃时,升温或降温都可将MgSO4不饱和溶液变为饱和溶液 D、t2℃时,蒸发少量水一定可使NaCl晶体从不饱和溶液中析出20. 一氧化碳在高温下还原48g氧化铁,一段时间后,剩余固体质量为46.4g,则剩余固体的成分不可能的情况为( )A、Fe、Fe2O3 B、Fe、FeO C、FeO、Fe2O3 D、Fe、Fe3O4、Fe2O3 、FeO二、填空题
-
21. 下表列出的是1~18号元素的最高正化合价和最低负化合价
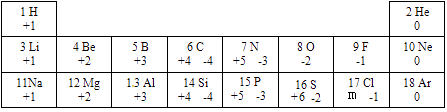 (1)、11号元素在化学反应中形成的离子是;(2)、16号元素的质子数为;其对应最高价氧化物的化学式为;(3)、由上表数据分析可知,m=。22. 现有6种物质:①磁铁矿、②水、③干冰、④氯酸钾、⑤氮气、⑥石灰水。
(1)、11号元素在化学反应中形成的离子是;(2)、16号元素的质子数为;其对应最高价氧化物的化学式为;(3)、由上表数据分析可知,m=。22. 现有6种物质:①磁铁矿、②水、③干冰、④氯酸钾、⑤氮气、⑥石灰水。请用相应物质的序号填空:
(1)、空气中含量最多的气体是;(2)、实验室中最常用的溶剂是;(3)、可用于实验室制取氧气的是;(4)、可用于人工降雨的是;(5)、可用于高炉炼铁的原料是;23. 图是初中化学常见的气体发生装置。 (1)、仪器a的名称是;(2)、实验室制取CO2的化学方程式是;
(1)、仪器a的名称是;(2)、实验室制取CO2的化学方程式是;利用该装置制取CO2时,为了防止CO2从长须漏斗中逸出,应;
(3)、写出检验CO2时有关的化学方程式:;三、简答题
-
24. 溶解是生活中常见的现象,不同物质在水中的溶解能力不同。(1)、下表是KNO3 、NaCl在不同温度下的溶解度:
温度(℃)
0
20
30
40
60
KNO3
13.3
31.6
45.8
63.9
110
NaCl
35. 7
36. 0
36.3
36. 6
37.3
①20℃时,将40gNaCl放入100g水中,所得溶液的质量是g;
②要除去KNO3中少量的NaCl应用的方法是;
③硝酸钾和氯化钠在t℃时的溶解度均为W,分析上表可推知,W的数值所在的最小范围是;
(2)、用硫酸铜粉末进行如图a、b、c所示的实验,完成下列填空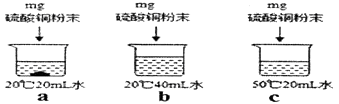
所得三种溶液中一定属于饱和溶液的是 , 溶质的质量分数由大到小的关系是。
四、综合题
-
25. 气体压力传感器可用于检测密闭体系内的气压变化,并以数字、曲线等多种形式形象地显示出来。下图1为空气含量测定的实验装置。
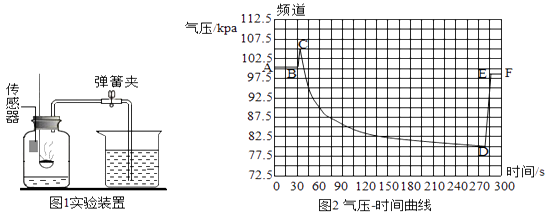
连接好实验装置,将压力传感器接入电脑并打开,点燃燃烧匙内的足量的红磷并塞入集气瓶。集气瓶内气压—时间关系如图2所示
(1)、图像中CD段气压变化的原因是① , ②;
(2)、图像中AB段气压不变的原因是 , 导致DE段气压变化的实验操作是
(3)、图1中集气瓶内空气为224mL,其中氧气的质量为0.064g,要将氧气完全消耗,理论上至少需要红磷多少克?26. 2016年10月19日,“神舟十一号”载人飞船与“天宫二号”空间实验室成功实现自动交会对接。(1)、肼(N2H4)是一种火箭燃料。肼和四氧化二氮(N2O4)两种液体作火箭推进剂时,两者混和反应生成氮气和水,写出该反应的化学方程式:;(2)、偏二甲肼(C2H8N2)也是一种火箭燃料,下列关于偏二甲肼的说法正确的是 (填序号);A、偏二甲肼属于纯净物 B、偏二甲肼分子是由碳元素、氢元素、氮元素组成的 C、偏二甲肼中碳、氢、氧各元素的质量比为1:4:1 D、偏二甲肼的相对分子质量为60(3)、肼作为火箭燃料,其优点是①、②。27. 2016年J1月6日,“蛟龙”号设计师崔维成介绍:2020年我国将挑战万米载人深潜,“彩虹鱼”号深潜器将挑战11000米马里亚纳海沟,实现人类历史上第三次载人探底,这将是中国人首次实现载人探底深渊极限。(1)、“蛟龙”号身披能抗超高压的钛合金"龙甲”。铁合金属于材料,它的硬度(填“大于”或“小于”)金属钛的硬度;(2)、深海海航中可观测海底的“热液”和“冷泉”现象。前者是海水渗入地下,被熔岩加热后重返海底的活动。海水中丰富矿物在重返地表时遭遇冷水后沉积,沉积的主要原因是;(3)、“冷泉”是海底天然气的溢出。我田南海发现可燃冰,其主要成分是CH4•nH2O,完全燃烧生成二氧化碳和水,写出该反应的化学方程式:。五、实验探究题
-
28. 纳米铁粉在空气中不自燃,稍加热即剧烈燃烧。某化学兴趣小组设计如图所示实验装置验证纳米铁粉燃烧符合质量守恒定律。
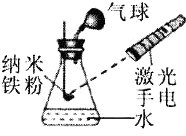 (1)、【步骤与现象】
(1)、【步骤与现象】①如图所示搭装置、装药品;
②称量整个装置质量为m;
③用激光手电照射纳米铁粉,剧烈燃烧,得黑色固体;
④ 。
(2)、【反思与分析】①纳米铁粉燃烧的化学方程式是;
②实验过程中气球变化情况是;
③得到的黑色固体中常含有少量铁。验证黑色固体中含有铁的方法是(用化学方程式表示)。
29. 某化学兴趣小组利用如图所示装置探究燃烧条件。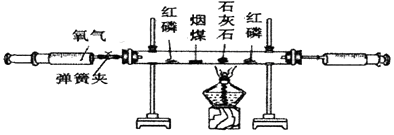
【查阅资料】红磷的着火点为260℃,烟煤的着火点为550℃
(1)、【提出猜想】猜想1:;猜想2:物质需要与氧气接触
猜想3:;
(2)、【实验探究】实验步骤
实验现象
实验结论
①连接装置,打开弹簧夹,;
装置气密性良好
②装药品
③点燃酒精灯,对准石灰石部位加热
右侧红磷燃烧,石灰石不燃烧
猜想1成立
④待右边红磷(足量)熄灭后,;
猜想2成立
⑤
左侧红磷燃烧,烟煤不燃烧
猜想3成立
(3)、【反思交流】①实验过程中右侧注射器的作用是;
②有同学认为本实验中石灰石是多余的,理由是。
30. 过碳酸钠(2Na2CO3•3H2O2 , 相对分子质量为314)是一种很好的消毒剂和供氧剂,常用于洗涤、印染、纺织、造纸、医药卫生等领域。Ⅰ.制备过碳酸钠
【查阅资料】过碳酸钠难溶于异丙醇,可浴于水,易发生反应:
2Na2CO3•3H2O2 =2Na2CO3+3H2O2;碳酸钠与碳酸钙一样也能与盐酸反应放出二氧化碳。
【制备流程】
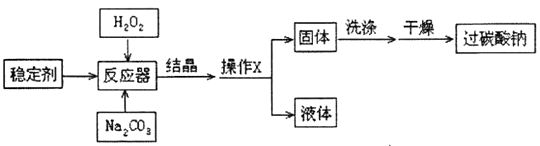 (1)、操作X是;(2)、流程中结晶在常温下进行,原因是;(3)、为提高产品的纯度,碳酸钠和过氧化氢的最佳投料质量比是 , 洗涤固体时,选用的最佳试剂是。(4)、II.神奇的“氧立得”
(1)、操作X是;(2)、流程中结晶在常温下进行,原因是;(3)、为提高产品的纯度,碳酸钠和过氧化氢的最佳投料质量比是 , 洗涤固体时,选用的最佳试剂是。(4)、II.神奇的“氧立得”小明同学新买了一台氧立得便携式制氧器,其中有A、B两包固体,B包为黑色固体粉未,经查阅资料知A包主要成分为过碳酸钠。将A包、B包药品分别放入机器,就可以制得氧气。为探究A包固体的纯度,设计了如下图所示实验装置
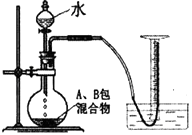
【实验步骤】
①检查装置气密性;
②称取2.2gA包药品和少许B包药品,并全部装入烧瓶内;
③按图搭好装置;④现将橡胶管插入量筒底部;
⑤打开分液漏斗;⑥待反应停止后,保持橡胶管口在量筒底部;
⑦等试管冷却到室温时将橡胶管移出水槽,读取量筒读数为220mL;
⑧数据处理。[氧气在实验条件下密度为1.43g/L]
【问题讨论】
B固体成分为(填化学式),实验时烧瓶内可观察到的现象是
(5)、如果将步骤④和⑤对调,实验结果将(选填“偏大”、“偏小”或“不变”),理由题是;(6)、证明反应停止后烧瓶中有碳酸钠的方法是;
(7)、此样品中过磺酸钠的质量分数为。
-