浙教版八下科学第二单元微粒的模型与符号培优提升训练卷
试卷日期:2025-03-13 考试类型:单元试卷
一、选择题(每小题2分,共40分)
-
1. 北京时间2023年11月30日零点,同济大学材料学院许维教授团队在国际顶级学术期刊《自然》(Nature)在线发表了最新科研成果:首次成功合成了环形纯碳分子材料,即芳香性环型碳和 , 1个芳香性环型碳分子中共含有10个( )A、原子 B、质子 C、中子 D、电子2. 模型常常可以帮助人们认识和理解一些不能直接观察到的或复杂的事物。下列不属于模型的是( )A、
 电压表
B、
电压表
B、 甲烷结构
C、
甲烷结构
C、 原子结构
D、
原子结构
D、 叶的结构
3. 原子结构模型的建立是经过一代代科学家不断地发现和提出新的原子结构模型的过程。下列有关图①②③所示的三种原子结构模型的叙述错误的是( )
叶的结构
3. 原子结构模型的建立是经过一代代科学家不断地发现和提出新的原子结构模型的过程。下列有关图①②③所示的三种原子结构模型的叙述错误的是( ) A、汤姆生认为图①模型中正电荷均匀分布在整个面包内,电子像葡萄干镶嵌其中 B、如图②模型玻尔认为电子只能在原子内的一些特定的稳定轨道上绕核运动 C、卢瑟福在实验的基础上提出带负电的电子绕带正电且体积很小的原子核运动的图③模型 D、依据提出时间先后顺序,正确的排列是①②③4. 硫代硫酸钠(Na2S2O3)在纺织业等领域有广泛的应用,Na2S2O3中硫元素显( )A、-2价 B、+2价 C、+4价 D、+6价5. 原子核内有6个质子和6个中子的一个碳原子的质量为akg,另一种元素的相对原子质量 b, 则该元素的一个原子的质量为( )A、 B、 C、 D、6. 已知、混合物中铁元素的质量分数为a%,则硫元素的质量分数为( )A、 B、 C、 D、无法计算7. 四位同学对某化学式的意义进行了讨论,甲说:“表示一种物质。”乙说:“表示一个分子。”丙说:“表示该物质由同种元素组成。”丁说:“表示一个分子由两个原子构成。”下列符号中,满足上述说法的是( )A、 B、Fe C、 D、H8. 对于下列几种化学符号,有关说法正确的是( )
A、汤姆生认为图①模型中正电荷均匀分布在整个面包内,电子像葡萄干镶嵌其中 B、如图②模型玻尔认为电子只能在原子内的一些特定的稳定轨道上绕核运动 C、卢瑟福在实验的基础上提出带负电的电子绕带正电且体积很小的原子核运动的图③模型 D、依据提出时间先后顺序,正确的排列是①②③4. 硫代硫酸钠(Na2S2O3)在纺织业等领域有广泛的应用,Na2S2O3中硫元素显( )A、-2价 B、+2价 C、+4价 D、+6价5. 原子核内有6个质子和6个中子的一个碳原子的质量为akg,另一种元素的相对原子质量 b, 则该元素的一个原子的质量为( )A、 B、 C、 D、6. 已知、混合物中铁元素的质量分数为a%,则硫元素的质量分数为( )A、 B、 C、 D、无法计算7. 四位同学对某化学式的意义进行了讨论,甲说:“表示一种物质。”乙说:“表示一个分子。”丙说:“表示该物质由同种元素组成。”丁说:“表示一个分子由两个原子构成。”下列符号中,满足上述说法的是( )A、 B、Fe C、 D、H8. 对于下列几种化学符号,有关说法正确的是( )①H②Fe2+ ③Cu ④P2O5 ⑤Fe3+ ⑥NaCl
A、能表示一个分子的是①④⑥ B、能表示物质组成的化学式是③④⑥ C、②⑤的质子数相同,化学性质也相同 D、④中的数字“5”表示五氧化二磷中有五个氧原子9. 《中国科学报》报道:中科院近代物理研究所首次合成新型铀-214,铀-238与铀-214相关信息如图所示。下列说法错误的是( ) A、铀-214的中子数为146 B、铀-238原子的核外电子数为92 C、铀-238与铀-214属于同种元素 D、铀-238原子的质量大于铀-21410. 小金对某元素三种同位素的结构示意图,进行了相关阐述,不合理的是( )
A、铀-214的中子数为146 B、铀-238原子的核外电子数为92 C、铀-238与铀-214属于同种元素 D、铀-238原子的质量大于铀-21410. 小金对某元素三种同位素的结构示意图,进行了相关阐述,不合理的是( ) A、图示的是氢元素 B、“
A、图示的是氢元素 B、“ ”表示电子,带负电,质量远小于质子
C、“
”表示电子,带负电,质量远小于质子
C、“ ”表示中子,不带电,三种同位素的中子数不同
D、“
”表示中子,不带电,三种同位素的中子数不同
D、“ ”表示质子,带正电,与中子的个数和质量都相等
11. 如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子。下列说法正确的是( )
”表示质子,带正电,与中子的个数和质量都相等
11. 如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子。下列说法正确的是( ) A、决定该原子种类的粒子是b B、原子中b与c的数目一定相同 C、原子中a 与c的数目一定相同 D、原子的质量集中在a和c上12. 有些年轻人喜欢染发,染发时一般要用到一种着色剂——对苯二胺,它是一种有毒的化学 药品,有致癌性,会对染发者的身体带来伤害,其分子结构如图所示。下列有关对苯二胺的 说法不正确的是( )
A、决定该原子种类的粒子是b B、原子中b与c的数目一定相同 C、原子中a 与c的数目一定相同 D、原子的质量集中在a和c上12. 有些年轻人喜欢染发,染发时一般要用到一种着色剂——对苯二胺,它是一种有毒的化学 药品,有致癌性,会对染发者的身体带来伤害,其分子结构如图所示。下列有关对苯二胺的 说法不正确的是( ) A、对苯二胺的化学式为C6H8N2 B、对苯二胺能被皮肤少量吸收 C、对苯二胺中碳、氢、氮元素的质量分数之比为18:2:7 D、对苯二胺由6个碳原子、8个氢原子和2个氮原子构成的13. 下列粒子结构示意图得出的结论中,错误的是( )
A、对苯二胺的化学式为C6H8N2 B、对苯二胺能被皮肤少量吸收 C、对苯二胺中碳、氢、氮元素的质量分数之比为18:2:7 D、对苯二胺由6个碳原子、8个氢原子和2个氮原子构成的13. 下列粒子结构示意图得出的结论中,错误的是( ) A、①④ 属于同种元素 B、②③④ 属于离子 C、⑤ 易失去电子成为阳离子 D、①⑤ 的结构不稳定14. 下图是表示气体分子得示意图,图中“○ “ ● ”分别表示两种不同质子数的原子,其中表示化合物的是 ()A、
A、①④ 属于同种元素 B、②③④ 属于离子 C、⑤ 易失去电子成为阳离子 D、①⑤ 的结构不稳定14. 下图是表示气体分子得示意图,图中“○ “ ● ”分别表示两种不同质子数的原子,其中表示化合物的是 ()A、 B、
B、 C、
C、 D、
D、 15. 大蒜中含有一种成分——辣素“硫化丙烯”,其化学式为 , 能杀菌,具有一定的抗病毒功能和食疗价值。下列关于硫化丙烯的说法中正确的是( )A、1个硫化丙烯分子中含有3个氢分子 B、1个硫化丙烯分子由3个碳原子、6个氢原子、1个硫原子构成 C、硫化丙烯由碳、氢、氧三种元素组成 D、硫化丙烯分子中C、H、S三种元素的质量比为3∶6∶116. 某同学学了元素和物质的知识后,进行知识梳理,其中不正确的是( )A、铁元素的质量分数由高到低:Fe3O4>Fe2O3>FeS B、钙的化合物相对分子量由大到小:CaCO3>CaCl2>Ca(OH)2 C、地壳中元素的含量由高到低:O>Si>Al D、锰元素的化合价由高到低:KMnO4>K2MnO4>MnO217. 丁烷是液化石油气的主要成分之一,其分子结构模型如图所示。下列有关叙述正确的是()
15. 大蒜中含有一种成分——辣素“硫化丙烯”,其化学式为 , 能杀菌,具有一定的抗病毒功能和食疗价值。下列关于硫化丙烯的说法中正确的是( )A、1个硫化丙烯分子中含有3个氢分子 B、1个硫化丙烯分子由3个碳原子、6个氢原子、1个硫原子构成 C、硫化丙烯由碳、氢、氧三种元素组成 D、硫化丙烯分子中C、H、S三种元素的质量比为3∶6∶116. 某同学学了元素和物质的知识后,进行知识梳理,其中不正确的是( )A、铁元素的质量分数由高到低:Fe3O4>Fe2O3>FeS B、钙的化合物相对分子量由大到小:CaCO3>CaCl2>Ca(OH)2 C、地壳中元素的含量由高到低:O>Si>Al D、锰元素的化合价由高到低:KMnO4>K2MnO4>MnO217. 丁烷是液化石油气的主要成分之一,其分子结构模型如图所示。下列有关叙述正确的是() A、丁烷中碳、氢元素的个数比为2∶5 B、丁烷分子中氢元素的质量分数最大 C、丁烷是由碳、氢原子构成的化合物 D、在通常状况下,丁烷是气体18. 元素X的核电荷数为a,它的阳离子Xm+与元素Y的阴离子Yn-的电子层结构完全相同,则元素Y的核电荷数是( )A、a+m+n B、a-m-n C、m+n-a D、m-n-a19. 一种有趣的钟表式元素周期表如图所示,下列说法中不正确的是( )
A、丁烷中碳、氢元素的个数比为2∶5 B、丁烷分子中氢元素的质量分数最大 C、丁烷是由碳、氢原子构成的化合物 D、在通常状况下,丁烷是气体18. 元素X的核电荷数为a,它的阳离子Xm+与元素Y的阴离子Yn-的电子层结构完全相同,则元素Y的核电荷数是( )A、a+m+n B、a-m-n C、m+n-a D、m-n-a19. 一种有趣的钟表式元素周期表如图所示,下列说法中不正确的是( ) A、一点整,时针所指元素为金属元素 B、六点整,时针所指元素的质子数为6 C、十一点整,时针所指元素的离子符号为Na D、钟面上时针、分针所指的两种元素组成化合物的化学式为MgO20. 1934年科学家在实验中发现了氢元素的一种同位素原子—氚,氚的质子数为1,中子数为2,则下列能表示其原子结构的是( )
A、一点整,时针所指元素为金属元素 B、六点整,时针所指元素的质子数为6 C、十一点整,时针所指元素的离子符号为Na D、钟面上时针、分针所指的两种元素组成化合物的化学式为MgO20. 1934年科学家在实验中发现了氢元素的一种同位素原子—氚,氚的质子数为1,中子数为2,则下列能表示其原子结构的是( ) A、
A、 B、
B、 C、
C、 D、
D、
二、填空题(每空1分,共 40分)
-
21. 阅读下列短文并回答相关问题。
【资料一】排入大气中的CO2越来越多,导致温室效应增强。减少CO2排放,实现碳中和,已成为全球共识。碳替代、碳减排、碳封存、碳循环是实现碳中和的四种主要途径。科学家预测,四种途径对全球碳中和的贡献率如图所示。
由资料一可知:
(1)到2050年,对全球碳中和贡献最大的途径为 。
(2)碳中和是指CO2的排放量和减少总量相当。下列做法中,有利于实现此目标的是 (填标号)。
A.用太阳能、风能等清洁能源代替化石燃料的使用
B.大规模开采可燃冰
C.大力植树造林,严禁乱砍滥伐
【资料二】氢气是21世纪正在开发利用的一种清洁能源,使用氢能源能有效减少CO2的排放。我国科学家研究的一种储氢、释氢材料为固体AlH3 , 其中释放氢能原理是利用AlH3与H2O发生反应,生成Al(OH)3和氢气。
由资料二可知:
(3)释放氢能的化学方程式为 ;该反应生成物中氢元素的化合价为 。
(4)释氢材料AlH3中,氢元素的质量分数为 。
 22. 二甲基硅油(C6H18OSi2)是洗发水中的常见成分之一,无味,透明度高,具有一定的耐热性、耐寒性和导热性。二甲基硅油无毒无味,具有良好的化学稳定性。若该物质超过标准,很容易产生二恶烷(C4H8O2)物质对肌肤以及头发造成严重影响。
22. 二甲基硅油(C6H18OSi2)是洗发水中的常见成分之一,无味,透明度高,具有一定的耐热性、耐寒性和导热性。二甲基硅油无毒无味,具有良好的化学稳定性。若该物质超过标准,很容易产生二恶烷(C4H8O2)物质对肌肤以及头发造成严重影响。(1)“透明度高”属于二甲基硅油的(填“物理”或“化学”)性质。
(2)C6H18O2Si2中C、H、O、Si四种元素的原子个数比为。
(3)恶烷(C4H8O2)中碳元素的质量分数为。(结果精确到0.1%)
23. 在一种M的氧化物中,M与氧元素的质量比为7:20,M与氧的相对原子质量比为7:8,那么M的相对原子质量为 , M的氧化物中M元素的化合价为。24. 元素周期表是化学学习和研究的重要工具。如图所示为元素周期表的一部分。族
周期
ⅠA
ⅡA
ⅢA
AⅣ
ⅤA
ⅥA
0Ⅶ
0
第二周期
3Li
7
4Be
9
5B
11
①
7N
14
8O
16
9F
19
10Ne
20
第三周期
11Na
23
②
13AI
27
14Si
28
③
16S
32
17Cl
35.5
18Ar
40
(1)图甲是某元素的原子结构示意图,该元素在表中的位置是(填“①”“②”或“③”),它属于(填“金属”“非金属”或“稀有气体”)元素。

(2)图乙是氯元素原子结构示意图,该原子核外有个电子层,表中与氯元素在同一纵行的氟元素,其原子结构与氯原子相似。试推测。氟原子在化学反应中易(填“得到”或“失去”)电子。形成的离子的符号是。
(3)不同种元素最本质的区别是(填字母)。
A.质子数不同 B.中子数不同
C.电子数不同 D.相对原子质量不同
25. 现有Na2S、Na2SO3、Na2SO4组成的混合物,经测定其中硫元素的质量分数为32%,则该混合物中氧元素的质量分数为。26.(1)、某三价金属氧化物中氧元素的质量分数为30%,则该金属元素的相对原子质量为。(2)、A、B两元素的相对原子质量之比为2:1,仅由这两种元素组成的化合物里,A、B两元素的质量比为2:3,则该化合物的化学式为 ;若其中B元素为-n价,则此化合物中 A元素的化合价为。(3)、元素 R 有多种氧化物,其中 RO 中含氧53.33%,那么相对分子质量为 76,含氧为63.15%的 R的氧化物的化学式是 。27. 有核电荷数均小于20的A、B、C、D四种元素。A和B能形成A₂B,其中A元素的质量分数约为11.1%,A元素原子内有1个质子,C原子和D+分别比A原子多11个和9个电子,试回答下列问题。(1)、写出各元素的名称:A , C。(2)、写出B和D元素能组成化合物的化学式:。28. 铝原子(Al)和铝离子(Al³⁺)属于同一种元素,因为它们的相同。Al和Al+属于(填“相同”或“不同”,下同)的粒子,因为它们的核外电子总数。29. 对某种赤铁矿进行测定分析,发现其含主要成分氧化铁(Fe₂O₃)的质量分数为80%(杂质不含铁元素),则其含铁元素的质量分数为。另取一赤铁矿样品120克,经测定含铁元素49.7克,则该赤铁矿样品中氧化铁(Fe₂O₃)的质量分数为(结果精确到0.1%)。30. 若某溶液中仅含 Na⁺、Mg²⁺、和Cl⁻四种离子,其中离子个数比为则 Na⁺:的个数比为。31. 由碳、氢两种元素组成的环状有机化合物中,从含三个碳原子到含十个碳原子的碳氢化合物依次按丙、丁、戊、己、庚、辛、壬、癸来标记碳原子数,并根据碳原子数命名为“环某烷”。如环丙烷,其化学式为 , 结构式如图甲所示,也可简写为图乙。现有一种由碳、氢两种元素组成的有机环状化合物,其结构式简写成图丙,该物质的名称是 , 化学式为。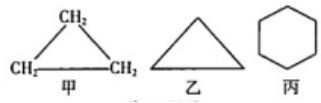 32. 1911年,卢瑟福等人用一些高速运动的α粒子(由两个中子和两个质子构成)轰击金箔,发现大多数α粒子穿过金箔后仍保持原来的运动方向,少数α粒子发生了较大角度的偏转,极少数α粒子发生反弹。(1)、统计不同偏转角度的α粒子数量,符合实验现象的图像是____。A、
32. 1911年,卢瑟福等人用一些高速运动的α粒子(由两个中子和两个质子构成)轰击金箔,发现大多数α粒子穿过金箔后仍保持原来的运动方向,少数α粒子发生了较大角度的偏转,极少数α粒子发生反弹。(1)、统计不同偏转角度的α粒子数量,符合实验现象的图像是____。A、 B、
B、 C、
C、 D、
D、 (2)、1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子。根据所学知识推测,被打出的微粒一定是。33. 由 NaHS、MgSO4、NaHSO3组成的混合物中,已知硫元素的质量分数为a%, 则氧元素的质量分数为。由Na2S、NaHS、NaOH组成的混合物中,若钠元素的质量分数为46%,则混合物中一定含有的物质是。34. 甲烷是天然气的主要成分,可作为燃料使用。用“
(2)、1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子。根据所学知识推测,被打出的微粒一定是。33. 由 NaHS、MgSO4、NaHSO3组成的混合物中,已知硫元素的质量分数为a%, 则氧元素的质量分数为。由Na2S、NaHS、NaOH组成的混合物中,若钠元素的质量分数为46%,则混合物中一定含有的物质是。34. 甲烷是天然气的主要成分,可作为燃料使用。用“ ”表示碳原子,“○”表示氢原子,甲烷分子可表示为
”表示碳原子,“○”表示氢原子,甲烷分子可表示为 (1)、甲烷的化学式为(2)、每个甲烷分子由个原子构成(3)、甲烷中碳元素的化合价为
(1)、甲烷的化学式为(2)、每个甲烷分子由个原子构成(3)、甲烷中碳元素的化合价为三、实验探究题(每空1分,共8 分)
-
35. 1911年,英国科学家卢瑟福进行了著名的a粒子散射实验,提出了原子的核式结构模型,为原子模型的建立做出了重大贡献。小科同学在项目化学习中,使用若干辐射环磁体(如图乙所示,两个磁极分别位于内外两环)、金属板、橡皮筋等器材制作了一个演示模型,用以模拟α粒子散射的动态过程,演示模型的制作过程如下:

①如图甲所示,将长条金属板弯折成环形(保留 10cm的缺口),并固定在桌面上;
②在环形金属板中央放置一块直径 5cm、重40g的辐射环磁体;
③在环形金属板的缺口处连接一段橡皮筋(图中未画出),用以向环内“发射α粒子”。
根据演示模型并结合所学知识回答:
(1)、固定在环形金属板中央的磁体,用来模拟的是原子中的哪一结构?(2)、下列四个辐射环磁体中最适合用作模拟被发射的“α粒子”的是____(填字母编号)。A、直径2cm、重5g、内环N极、外环S极 B、直径5cm、重40g、内环S极、外环N极 C、直径2cm、重5g、内环S极、外环N极 D、直径5cm、重40g、内环N极、外环S极(3)、该实验很好地模拟了卢瑟福α粒子散射实验的现象,即α粒子穿过金属箔后的运动情况为:。(4)、小科同学通过环形金属板的缺口处向内依次发射12颗“α粒子”,这些“α粒子”最终会吸附在环形金属板上。在模拟实验完成后,将环形金属板展平,下图中最符合实际情况的是(填字母编号,金属板上的点代表被吸附的“α粒子”)。 36. 通过对已学知识的对比和归纳,我们往往可以得出一些十分有趣的规律,这些规律可以帮助我们掌握学习科学的方法.请仔细阅读下表中的内容,并回答相应的问题:
36. 通过对已学知识的对比和归纳,我们往往可以得出一些十分有趣的规律,这些规律可以帮助我们掌握学习科学的方法.请仔细阅读下表中的内容,并回答相应的问题:常见的几种离子
H+ Na+ Mg2+ OH﹣ Cl﹣ SO42﹣
对应元素及原子团
在化合物中的化合价
、 、 、O 、 、S
所能形成化合物的化学式
酸
碱
盐
HCl、H2SO4
NaOH、Mg(OH)2
MgCl2、Na2SO4
(1)、由前两行内容对照可得出的规律是:元素或原子团的化合价数值往往与相应离子所带的数相等.(2)、由后两行内容对照可得出的规律是:通过元素或原子团的可以确定相应化合物的化学式.(3)、利用表中所给内容,请你写出硫酸钠的化学式 .(4)、根据硫酸亚铁的化学式FeSO4 , 可推出该物质所含阳离子的符号为 .四、综合题(第39题最后一空2分,其他都1分,共12分)
-
37. 核事故时往往泄漏出污染物(具有放射性的碘原子)。为避免核辐射,需一次性口服100毫克(不具放射性的碘原子),使人体甲状腺中碘达到饱和而不再吸收外界的碘,从而起到保护作用。请回答:(1)、“具有放射性的碘原子”和“不具有放射性的碘原子”两者的关系是____。A、同种元素 B、同种物质 C、同种分子 D、同种原子(2)、若所处的环境已受污染,通过服用加碘食盐(注:加碘食盐中的碘为碘酸钾)的方法能否有效起到避免核辐射的目的呢?
查阅资料:成人每天食用食盐的质量通常为6g;某种加碘食盐的标签如图所示。
配料表:氯化钠、碘酸钾(KIO3)
净含量:500g
碘含量(以I计):20~50mg/kg
问题分析:500g该品牌食盐中,含碘的最大质量是;若要使人体甲状腺中的碘达到饱和,至少需要一次性食用该品牌碘盐。
结论:日常服用加碘食盐(选填“能”或“不能”)起到避免核辐射目的。
38. 中国工程院院士钟南山曾说我从小就一直喝牛奶,每天都会喝两杯,长时间喝牛奶非常有帮助,营养非常全面,确实是一件好事。对于青少年的身体发育也有着非常重要的作用,政府推出了学生奶,如图是学生奶包装标签的部分文字,仔细阅读后回答: (1)、标签中的“钙”是指。(填“原子”“元素”或“离子”)(2)、包装标签中脂肪4.0g的意思,是指100mL牛奶中含脂防质量4.0g,那么一盒牛奶含钙多少克?(3)、若人体每天需要0.68钙,且这些钙有90%来自于牛奶,则一个人至少要喝多少盒牛奶?39. 物质是由微观粒子构成的,微观粒子是有一定质量的。(1)、已知钾原子质量为一个碳-12原子(相对原子质量是12)质量的3.25倍,则钾原子的相对原子质量为。(2)、已知Cu和Ag的相对原子质量分别为64和108,则等质量的这两种金属所含原子个数较多的是。(3)、醋是生活中常用的调味剂,其主要成分乙酸的分子结构模型如图所示。
(1)、标签中的“钙”是指。(填“原子”“元素”或“离子”)(2)、包装标签中脂肪4.0g的意思,是指100mL牛奶中含脂防质量4.0g,那么一盒牛奶含钙多少克?(3)、若人体每天需要0.68钙,且这些钙有90%来自于牛奶,则一个人至少要喝多少盒牛奶?39. 物质是由微观粒子构成的,微观粒子是有一定质量的。(1)、已知钾原子质量为一个碳-12原子(相对原子质量是12)质量的3.25倍,则钾原子的相对原子质量为。(2)、已知Cu和Ag的相对原子质量分别为64和108,则等质量的这两种金属所含原子个数较多的是。(3)、醋是生活中常用的调味剂,其主要成分乙酸的分子结构模型如图所示。
①乙酸中碳原子和氢原子的个数比为。
②乙酸可由乙醛制得,乙醛的化学式为C2HxO,其相对分子质量为44,则x=。