新浙教版(2024版)七年级下册 2.4 探究物质组成的奥秘 同步训练
试卷日期:2025-03-11 考试类型:同步测试
一、选择题
-
1. 青少年正处于身体的迅速生长发育时期,需要适量补充钙、锌等。这里的“钙”“锌”指的是( )A、单质 B、元素 C、离子 D、原子2. 下列元素符号和名称书写都正确的是( )A、铝:Al B、镁:MG C、铜:CU D、炭:C3. 下列符号既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )A、H B、 C、 D、4. 如图中“O”和“●”分别表示氢原子和氧原子,其中的粒子可用4H表示的是( )A、
 B、
B、 C、
C、 D、
D、 5. 2024年中国钠电池技术实现了重大突破。钠电池的高能量密度,使其成为新能源汽车等领域的理想选择。如右图,下列说法正确的是( )
5. 2024年中国钠电池技术实现了重大突破。钠电池的高能量密度,使其成为新能源汽车等领域的理想选择。如右图,下列说法正确的是( ) A、钠属于非金属元素 B、钠原子的质子数为23 C、钠的原子质量为22.99 D、钠原子与钠离子质量几乎相等6. 如图是金元素在元素周期表中的信息示意图,从图中获取的信息正确的是( )
A、钠属于非金属元素 B、钠原子的质子数为23 C、钠的原子质量为22.99 D、钠原子与钠离子质量几乎相等6. 如图是金元素在元素周期表中的信息示意图,从图中获取的信息正确的是( ) A、金元素属于非金属元素 B、一个金原子的中子数为197.0 C、一个金原子的核外电子数为118 D、一个金原子核带有79个单位的正电荷7. 有3种不同的原子,甲原子核内有6个质子和6个中子,乙原子核内有6个质子和8个中子,丙原子核内有7个质子和7个中子。下列说法正确的是( )A、甲和乙的核电荷数不同 B、甲和乙互为同位素原子 C、乙和丙核外电子数相等 D、乙和丙互为同位素原子8. 如图为元素周期表的一部分(X元素信息不全)。下列说法正确的是( )
A、金元素属于非金属元素 B、一个金原子的中子数为197.0 C、一个金原子的核外电子数为118 D、一个金原子核带有79个单位的正电荷7. 有3种不同的原子,甲原子核内有6个质子和6个中子,乙原子核内有6个质子和8个中子,丙原子核内有7个质子和7个中子。下列说法正确的是( )A、甲和乙的核电荷数不同 B、甲和乙互为同位素原子 C、乙和丙核外电子数相等 D、乙和丙互为同位素原子8. 如图为元素周期表的一部分(X元素信息不全)。下列说法正确的是( ) A、碳的原子质量为12.01g B、X属于非金属元素 C、三种元素的原子核外电子层数相同 D、X原子的中子数约为149. 如图是地壳中各元素的含量(质量分数)分布图,下列说法正确的是( )
A、碳的原子质量为12.01g B、X属于非金属元素 C、三种元素的原子核外电子层数相同 D、X原子的中子数约为149. 如图是地壳中各元素的含量(质量分数)分布图,下列说法正确的是( ) A、地壳中含量最多的元素是金属元素 B、地壳中非金属元素的总含量大于金属元素,种类少于金属元素 C、地壳中最多的金属元素是铝,也就是金属铝 D、由图可知,各元素在地壳中的含量相差不大10. 2019年是元素周期表诞生150周年。根据元素周期表我们无法得知的是某元素( )。A、一个原子核内的质子数 B、一个原子的质量 C、一个原子的核外电子数 D、是金属还是非金属元素11. 下列粒子结构示意图得出的结论中,错误的是( )
A、地壳中含量最多的元素是金属元素 B、地壳中非金属元素的总含量大于金属元素,种类少于金属元素 C、地壳中最多的金属元素是铝,也就是金属铝 D、由图可知,各元素在地壳中的含量相差不大10. 2019年是元素周期表诞生150周年。根据元素周期表我们无法得知的是某元素( )。A、一个原子核内的质子数 B、一个原子的质量 C、一个原子的核外电子数 D、是金属还是非金属元素11. 下列粒子结构示意图得出的结论中,错误的是( ) A、①④ 属于同种元素 B、②③④ 属于离子 C、⑤ 易失去电子成为阳离子 D、①⑤ 的结构不稳定12. 世界是由元素组成的.图中能正确表示地壳中元素含量分布的是( )A、
A、①④ 属于同种元素 B、②③④ 属于离子 C、⑤ 易失去电子成为阳离子 D、①⑤ 的结构不稳定12. 世界是由元素组成的.图中能正确表示地壳中元素含量分布的是( )A、 B、
B、 C、
C、 D、
D、 13. 下列符号中,既能表示一个原子,又能表示一种元素,还能表示一种物质的是( )A、CO2 B、Fe C、O2 D、H14. 2017年5月9日,由中国科学院等相关部门正式发布了113号、115号、117号、118号元素的中文名称。如表是这四种元素的部分信息,以下有关说法正确的是( )
13. 下列符号中,既能表示一个原子,又能表示一种元素,还能表示一种物质的是( )A、CO2 B、Fe C、O2 D、H14. 2017年5月9日,由中国科学院等相关部门正式发布了113号、115号、117号、118号元素的中文名称。如表是这四种元素的部分信息,以下有关说法正确的是( )原子序数
中文名称
符号
汉语拼音
113

nǐ
115
镆
mò
117

tián
118

ào
A、 属于金属元素
B、镆的元素符号是mò
C、
属于金属元素
B、镆的元素符号是mò
C、 元素的质子数与中子数之和为117
D、
元素的质子数与中子数之和为117
D、 元素在自然界中含量丰富
15.
元素在自然界中含量丰富
15.科学家发现一种新元素。该元素原子核外电子数为117,中子数为174,相对原子质量为291,元素名称Ununseptium,符号Uus。请模仿甲,将该元素对应信息编写到图乙中相应位置,“①”处应填( )
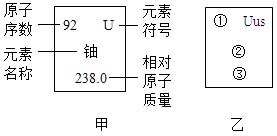 A、291 B、174 C、117 D、57
A、291 B、174 C、117 D、57二、填空题
-
16. 如图是元素周期表的一部分,请回答下列问题。

(1)周期表中位置②处的元素符号是 。
(2)Ne是一种 元素。(选填“金属”或“非金属”)
(3)写出表中②和③组成的化合物的化学式。
(4)He与Ne的(选填“物理性质”或“化学性质”)相似。
17. 元素周期表将已知元素科学有序地排列起来,便于我们研究它们的性质和用途。如表表示元素周期表的一部分,请回答下列问题。H
He
①
N
②
Ne
③
Si
Ar
(1)元素周期表中,同一族元素的 (填“物理”或“化学”)性质相似。
(2)元素在周期表中的分布是有规律的,表中①②③所代表的三种元素中,属于非金属的是 。
(3)利用表中已有元素,写出一种分子的构成与微粒模型“
 ”相似的物质的名称:。18. 元素周期表是学习和研究科学的重要工具,如图所示为元素周期表的一部分,其中①②③表示三种不同的元素。据图回答问题:
”相似的物质的名称:。18. 元素周期表是学习和研究科学的重要工具,如图所示为元素周期表的一部分,其中①②③表示三种不同的元素。据图回答问题: (1)、①表示的是元素。(2)、关于①②③三种元素的说法,正确的是____。A、原子序数③<② B、核外电子数①=② C、②和③处于同一周期
(1)、①表示的是元素。(2)、关于①②③三种元素的说法,正确的是____。A、原子序数③<② B、核外电子数①=② C、②和③处于同一周期三、实验探究题
-
19. 1932年 Linus Pauling 提出电负性(其值用希腊字母x表示)的概念,用来确定化合物中原子某种能力的相对大小。他假定F 的电负性为4,并通过热化学方法建立了其它元素的电负性。Linus Pauling 建立的部分元素的电负性如下:
H: 2.1
Li: 1.0
Be: 1.5
N: 3.0
O: 3.5
F: 4.0
Na: 0.9
Mg: 1.2
P: 2.1
S: 2.5
Cl: 3.0
K: 0.8
Ca: 1.0
As: 2.0
Se: 2.4
Br: 2.8
Rb: 0.8
Sr: 1.0
Sb: 1.9
Te: X
I: 2.5
Cs: 0.7
Ba: 0.9
Bi: 1.9
Po: 2.0
At: 2.2
Fr: 0.7
Ra: 0.9
回答下列问题:
(1)、写出元素电负性在上表中同一横行的递变规律:。(2)、 预测 Te 元素 x 的取值范围。(3)、大量事实表明,当两种元素的x值相差大于或等于1.7时,形成的化合物一般是离子化合物。根据此经验规律,KBr物质 (填“是”或“不是”) 离子化合物。20. 根据相对原子质量来研究元素,始于19世纪初。1829年,德国化学家德贝纳提出了锂钠钾、钙锶钡、磷砷锑、氯溴碘等15种元素,把这些元素称为“三种元素组”。1864年,德国化学家迈耶,按相对原子质量递增顺序制定了一个“六元素表”。1865年,英国化学家组兰兹按相对原子质量递增顺序,将已知元素作了排列。他发现第八个元素就与第一个元素性质相似(元素的排列每逢八就出现周期性)。这好像音乐上的八个音阶一样重复出现,于是提出“八音律”的理论(下表是“八音律表”的前部分)。H
Li
G
B
C
N
O
F
Na
Mg
Al
Si
P
S
1869年,俄罗斯化学家门捷列夫对当时已知的63种元素的相对原子质量和物理性质(熔点、密度等)进行了比较,直到19世纪末才制成了第一张元素周期表。事实上在1869年,德国的迈耶和俄国的门捷列夫几乎同时发现了元素周期律。
(1)、请你将Br、K、Mg三种元素按迈耶的元素表规律进行排列。(2)、根据纽兰兹“八音律表”,与Na性质相似的元素是。(3)、分析上述科学史料,判断下列观点正确的有 ____(可多选)。A、研究复杂的现象往往需要寻找规律 B、科学家在研究元素周期规律时,不需要借助技术手段 C、如果当时门捷列夫没有发现元素周期表,未来也会有其他科学家发现 D、随着科学的进步,我们现在所学的元素周期表已包含所有元素 E、纽兰兹的“八音律表”中没有稀有元素,说明他的理论是错误,没有作用的