浙江省温州市新希望学校2024学年第一学期九年级期中作业检查 科学学科试题(1.1-3.2)
试卷日期:2024-11-18 考试类型:期中考试
一、 选择题
-
1. 如图是浙江省部分非物质文化遗产,其主要制作过程属于化学变化的是( )A、
 乐清黄杨木雕
B、
乐清黄杨木雕
B、 海宁剪纸
C、
海宁剪纸
C、 龙泉青瓷烧制
D、
龙泉青瓷烧制
D、 永康锡艺
2. 体液的pH能够反映人体的健康状况,下表是四种体液的正常pH范围。据表可知,体液在正常pH范围都呈碱性的是( )
永康锡艺
2. 体液的pH能够反映人体的健康状况,下表是四种体液的正常pH范围。据表可知,体液在正常pH范围都呈碱性的是( )体液
唾液
胃液
血液
尿液
正常pH范围
6.6-7.1
0.8-1.5
7.35-7.45
4.6-8.0
A、唾液 B、胃液 C、血液 D、尿液3. 手机通过电磁波进行信息传递,这些电磁波就是人们常说的“手机辐射”。“手机辐射”具有( )A、机械能 B、电磁能 C、声能 D、化学能4. 下列物质的名称、俗称和化学式全部一致的是( )A、碳酸钠、苏打、 B、氢氧化钠、纯碱、NaOH C、氢氧化钙、生石灰、 D、氯化钠、食盐、NaCl5. 下列实验操作中正确的是( )A、 蒸发结晶
B、
蒸发结晶
B、 稀释浓硫酸
C、
稀释浓硫酸
C、 氢气还原氧化铜
D、
氢气还原氧化铜
D、 测溶液pH值
6. 高层建筑的楼顶常用钢铁材质的避雷针,其作用是将雷电引导到地下,该做法主要是利用钢铁具有( )A、金属光泽 B、延展性 C、导电性 D、导热性7. 图中“●”和“○”表示两种不同的原子,则下列模型中有可能表示氧化物的是( )A、
测溶液pH值
6. 高层建筑的楼顶常用钢铁材质的避雷针,其作用是将雷电引导到地下,该做法主要是利用钢铁具有( )A、金属光泽 B、延展性 C、导电性 D、导热性7. 图中“●”和“○”表示两种不同的原子,则下列模型中有可能表示氧化物的是( )A、 B、
B、 C、
C、 D、
D、 8. 城市绿化养护移栽的树木需要用到营养液,营养液中含有以下几种成分:①;②KCl;③;④ , 其中属于复合肥的是( )A、①② B、①③ C、②③ D、①④9. “神舟十七号”载人航空飞船为保护乘员安全,配备了安全气囊。气囊里的物质发生反应使气囊弹出,其反应原理之一为 , 该反应属于( )A、化合反应 B、置换反应 C、分解反应 D、复分解反应10. 下列有关酸和碱的个性,说法正确的是( )A、浓盐酸具有吸水性 B、氢氧化钠溶于水放出大量的热 C、氢氧化钙固体在空气中容易潮解 D、浓硫酸具有挥发性11. 通过实验可以比较铁、铜、银三种金属的活动性强弱。下列装置能够达到实验目的的是( )A、
8. 城市绿化养护移栽的树木需要用到营养液,营养液中含有以下几种成分:①;②KCl;③;④ , 其中属于复合肥的是( )A、①② B、①③ C、②③ D、①④9. “神舟十七号”载人航空飞船为保护乘员安全,配备了安全气囊。气囊里的物质发生反应使气囊弹出,其反应原理之一为 , 该反应属于( )A、化合反应 B、置换反应 C、分解反应 D、复分解反应10. 下列有关酸和碱的个性,说法正确的是( )A、浓盐酸具有吸水性 B、氢氧化钠溶于水放出大量的热 C、氢氧化钙固体在空气中容易潮解 D、浓硫酸具有挥发性11. 通过实验可以比较铁、铜、银三种金属的活动性强弱。下列装置能够达到实验目的的是( )A、 B、
B、 C、
C、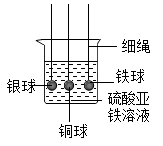 D、
D、 12. 物质的结构决定性质,性质决定用途。下列物质的结构、性质和用途之间匹配正确的是( )
12. 物质的结构决定性质,性质决定用途。下列物质的结构、性质和用途之间匹配正确的是( )选项
结构
性质
用途
A
稀盐酸中含有氢离子
具有酸性
具有酸性检验溶液中是否含有银离子
B
稀盐酸中含有氯离子
具有酸性
具有酸性检验溶液中是否含有银离子
C
氢氧化钠溶液中含有钠离子
具有碱性
具有碱性吸收二氧化硫气体
D
氢氧化钠溶液中含有氢氧根离子
具有碱性
具有碱性吸收二氧化硫气体
A、A B、B C、C D、D13. 如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。无论加入多少量的饱和石灰水,反应后试管内溶液一定呈碱性的是( ) A、① B、② C、③ D、④14. 下列化学方程式书写正确的是( )A、 B、 C、 D、15. 类推是学习中常用的思维方法。现有以下类推结果,其中错误的是( )
A、① B、② C、③ D、④14. 下列化学方程式书写正确的是( )A、 B、 C、 D、15. 类推是学习中常用的思维方法。现有以下类推结果,其中错误的是( )①酸碱中和反应生成盐和水,所以生成盐和水的反应一定是中和反应;②碱的水溶液显碱性,所以碱性溶液一定是碱溶液;③氧化物都含有氧元素,所以含有氧元素的化合物一定是氧化物;④有机物都含碳元素,所以含碳元素的化合物都是有机物。
A、只有① B、只有①②③ C、只有②③④ D、①②③④16. 下列除去杂质的方法中正确的是( )选项
物质
杂质
除杂质的方法
A
氯化钙溶液
稀盐酸
加过量碳酸钙,过滤
B
碳酸钾溶液
氯化钾
加适量稀盐酸
C
氧化钙
碳酸钙
加水,过滤
D
氯化钠溶液
碳酸钠
加适量硝酸钙溶液,过滤
A、A B、B C、C D、D二、填空题
-
17. 《天工开物》中记载古人挖煤时的情景“初见煤端时,毒气灼人”指挖煤时发现一种“毒气”(现俗称瓦斯),会造成人员伤亡。瓦斯的主要成分是甲烷,含少量一氧化碳、二氧化碳、硫化氢等气体,无色、易燃、有毒、密度比空气小。
 (1)、瓦斯的主要成分甲烷 , 属于化合物中的。(2)、古人挖煤时,会先打通竹子中的节,并将一端削尖,插入煤层中,待“毒气”沿竹子内部通向高空后,矿工再下到煤井挖煤,确保人员安全。这种做法主要利用的是瓦斯的物理性质。(3)、在现代,人们用氢氧化钠来吸收“毒气”中的硫化氢气体,其反应的化学方程式是: , X的化学式为。18. 芋芍是一种常见的食品,既可当粮食,又可作蔬菜。(1)、新鲜芋艿在去皮时会产生一种白色汁液,汁液内含有一种碱性物质——皂角甙,沾上它会奇痒难忍。下列物质可用来涂抹止痒的是____。A、食醋 B、熟石灰 C、食盐 D、纯碱(2)、有经验的人遇到这种情况,会将手靠近火源烘一烘,也可以达到止痒的效果;如果将带皮芋艿煮熟后,再用手去皮也不再会有痒的感觉。根据上述现象,请推测皂角甙的一种化学性质19. 下图是滚摆完成一次下降和上升的示意图,根据图中的信息回答下列问题。
(1)、瓦斯的主要成分甲烷 , 属于化合物中的。(2)、古人挖煤时,会先打通竹子中的节,并将一端削尖,插入煤层中,待“毒气”沿竹子内部通向高空后,矿工再下到煤井挖煤,确保人员安全。这种做法主要利用的是瓦斯的物理性质。(3)、在现代,人们用氢氧化钠来吸收“毒气”中的硫化氢气体,其反应的化学方程式是: , X的化学式为。18. 芋芍是一种常见的食品,既可当粮食,又可作蔬菜。(1)、新鲜芋艿在去皮时会产生一种白色汁液,汁液内含有一种碱性物质——皂角甙,沾上它会奇痒难忍。下列物质可用来涂抹止痒的是____。A、食醋 B、熟石灰 C、食盐 D、纯碱(2)、有经验的人遇到这种情况,会将手靠近火源烘一烘,也可以达到止痒的效果;如果将带皮芋艿煮熟后,再用手去皮也不再会有痒的感觉。根据上述现象,请推测皂角甙的一种化学性质19. 下图是滚摆完成一次下降和上升的示意图,根据图中的信息回答下列问题。 (1)、图中滚摆处于位置时,重力势能最大。(2)、图中滚摆完成一次下降和上升的过程中,滚摆的机械能是(选填“守恒”或“不守恒”)的。20. 如图是稀盐酸滴入装有氢氧化钠溶液的试管中,恰好完全反应的微观示意图,图中小球①②③④代表反应前后溶液中的不同离子种类。
(1)、图中滚摆处于位置时,重力势能最大。(2)、图中滚摆完成一次下降和上升的过程中,滚摆的机械能是(选填“守恒”或“不守恒”)的。20. 如图是稀盐酸滴入装有氢氧化钠溶液的试管中,恰好完全反应的微观示意图,图中小球①②③④代表反应前后溶液中的不同离子种类。 (1)、请写出稀盐酸与氢氧化钠反应的实质:。(2)、图中能使酚酞试液变红的离子是(选填“①”、“②”、“③”或“④”)。(3)、反应过程中,小明测得试管溶液的pH为10。但是他在测定时先用蒸馏水对pH试纸进行了湿润,所以小明测得的结果(选填“偏大”、“准确”或“偏小”)。21. 有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠、硝酸钾中的一种或几种组成,为检验其中的成分,按以下流程进行实验:
(1)、请写出稀盐酸与氢氧化钠反应的实质:。(2)、图中能使酚酞试液变红的离子是(选填“①”、“②”、“③”或“④”)。(3)、反应过程中,小明测得试管溶液的pH为10。但是他在测定时先用蒸馏水对pH试纸进行了湿润,所以小明测得的结果(选填“偏大”、“准确”或“偏小”)。21. 有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠、硝酸钾中的一种或几种组成,为检验其中的成分,按以下流程进行实验: (1)、根据实验现象,白色粉末中一定有 , (均填化学式)(2)、实验中不能用溶液代替溶液的理由是22. 如图所示为铜片A的系列变化,据图回答下列问题:
(1)、根据实验现象,白色粉末中一定有 , (均填化学式)(2)、实验中不能用溶液代替溶液的理由是22. 如图所示为铜片A的系列变化,据图回答下列问题: (1)、若方法1中的X物质为常见气体 , 则实验过程中观察到的现象是。(2)、铜片A、铜片B、铜片C的质量分别为。其中方法1和方法2均完全反应。则三者的大小关系为。
(1)、若方法1中的X物质为常见气体 , 则实验过程中观察到的现象是。(2)、铜片A、铜片B、铜片C的质量分别为。其中方法1和方法2均完全反应。则三者的大小关系为。三、实验与探究题
-
23. 小明为探究铁制品锈蚀的条件,利用右图装置进行实验:将干燥的氧气从导管a通入,使氧气充满U型管。一段时间后观察三处铁丝的变化情况。
 (1)、为确定U型管已经充满氧气,可进行的实验操作是。(2)、小明可以通过比较铁丝来探究纯铁丝是否不易锈蚀。(用图中编号表示)(3)、小红认为小明的实验还无法探究铁制品锈蚀是否需要的参与,她的理由是。24. 同学们把盛有自上而下依次呈现多种颜色溶液的试管称为“彩虹管”,其呈现出的颜色越多、保持时间越长,效果越好。已知黑枸杞浸取液在pH不同的溶液中呈现不同的颜色,可以用来制作“彩虹管”,过程如图所示。
(1)、为确定U型管已经充满氧气,可进行的实验操作是。(2)、小明可以通过比较铁丝来探究纯铁丝是否不易锈蚀。(用图中编号表示)(3)、小红认为小明的实验还无法探究铁制品锈蚀是否需要的参与,她的理由是。24. 同学们把盛有自上而下依次呈现多种颜色溶液的试管称为“彩虹管”,其呈现出的颜色越多、保持时间越长,效果越好。已知黑枸杞浸取液在pH不同的溶液中呈现不同的颜色,可以用来制作“彩虹管”,过程如图所示。
“彩虹管”效果受多个因素的影响,小明等同学对影响因素进行如下探究:向试管中加入6mL一定质量分数的盐酸、滴入5滴黑枸杞浸取液、振荡,再逐滴滴入约3mL一定质量分数的NaOH溶液,记录溶液颜色。结果如下表,请回答以下问题。
实验
盐酸中溶质的质量分数/%
NaOH溶液中溶质的质量分数/%
溶液颜色
①
5
5
红色
②
5
10
自上而下依次为红色、蓝色、黄色,静置约6分钟只剩红色、黄色
③
5
15
自上而下依次为红色、蓝色、黄色,静置约20分钟仍无明显变化
④
5
20
自上而下依次为红色、蓝色、黄色,静置约6分钟只剩黄色、蓝色
资料:黑枸杞浸取液颜色随pH的变化情况。
pH
4~5
6~8
9~11
12
溶液颜色
红色
粉色
紫色
蓝色
绿色
黄色
(1)、根据上述实验现象,可得出的结论是(2)、在此实验基础上,小明想要探究使“彩虹管”效果更好的氢氧化钠溶液溶质质量分数,该如何进行实验?。(3)、根据小明的实验过程,请推测还有哪些因素会影响“彩虹管”的效果?。25. 某项目学习小组设计如图甲所示的实验装置来模拟探究炼铁过程,其主要反应原理为: (1)、实验过程中,需要在点燃酒精喷灯之前,往装置中先通入适量一氧化碳气体,目的是。(2)、图乙是A瓶中导管a和b的三种安装方式,为更好的达成实验目的,应该选择图乙中的(①或②或③)集气瓶,原因是。(3)、小明认为不能用氢氧化钙溶液代替装置A中的氢氧化钠溶液,原因是。
(1)、实验过程中,需要在点燃酒精喷灯之前,往装置中先通入适量一氧化碳气体,目的是。(2)、图乙是A瓶中导管a和b的三种安装方式,为更好的达成实验目的,应该选择图乙中的(①或②或③)集气瓶,原因是。(3)、小明认为不能用氢氧化钙溶液代替装置A中的氢氧化钠溶液,原因是。四、 综合题
-
26. 老师演示了如下实验:在一定量的饱和硫酸铜溶液中加入浓硫酸,可以观察到液体上部呈蓝色、下部为无色,底部出现白色固体沉积(如图所示),试管壁发烫。经检测白色固体是无水硫酸铜。请结合浓硫酸的性质和所学知识对上述实验现象做出合理解释。
 27. 某兴趣小组进行某品牌牙膏中碳酸钙含量的测定实验。取8克该品牌牙膏样品(牙膏成分中除碳酸钙以外的物质均不参与反应),利用下图所示装置(图中夹持仪器略去,不考虑盐酸的挥发性)进行实验,其原理是
27. 某兴趣小组进行某品牌牙膏中碳酸钙含量的测定实验。取8克该品牌牙膏样品(牙膏成分中除碳酸钙以外的物质均不参与反应),利用下图所示装置(图中夹持仪器略去,不考虑盐酸的挥发性)进行实验,其原理是 (1)、对该实验用于吸收的装置丙中溶液的要求,下列有关分析正确的有____。(可多选)A、不能生成沉淀 B、必须有沉淀现象 C、有无生成沉淀都可以 D、不能有气体生成 E、必须是足量的(2)、实验前测得装置丙的质量142.60克,打开分液漏斗,滴加盐酸,充分反应后装置丙的质量为143.26克,鼓入一定量空气后再次测量装置丙的质量为143.48克,请根据实验数据计算该样品中碳酸钙的质量分数(写出计算过程)。(3)、小明想利用反应生成的沉淀质量来测定样品中碳酸钙的质量分数,于是他在装置丙中选用足量的氢氧化钡溶液,但最终测得结果数据偏差较大,原因可能是____;A、实验结束后通入空气速度太快,装置中的二氧化碳没有完全吸收 B、沉淀过滤后没有洗涤 C、沉淀没有干燥直接称量 D、称量沉淀质量时,砝码与药品位置放反了28. 金属与酸反应会放出热量。为深入研究金属和酸反应的特点,小明用如图甲所示装置进行实验:在烧瓶中加入0.48克镁和足量的溶质质量分数为的稀盐酸,塞紧瓶塞,利用传感器记录160秒内瓶内气压变化。用等质量的铁和锌重复上述实验,得到相关曲线如图乙。
(1)、对该实验用于吸收的装置丙中溶液的要求,下列有关分析正确的有____。(可多选)A、不能生成沉淀 B、必须有沉淀现象 C、有无生成沉淀都可以 D、不能有气体生成 E、必须是足量的(2)、实验前测得装置丙的质量142.60克,打开分液漏斗,滴加盐酸,充分反应后装置丙的质量为143.26克,鼓入一定量空气后再次测量装置丙的质量为143.48克,请根据实验数据计算该样品中碳酸钙的质量分数(写出计算过程)。(3)、小明想利用反应生成的沉淀质量来测定样品中碳酸钙的质量分数,于是他在装置丙中选用足量的氢氧化钡溶液,但最终测得结果数据偏差较大,原因可能是____;A、实验结束后通入空气速度太快,装置中的二氧化碳没有完全吸收 B、沉淀过滤后没有洗涤 C、沉淀没有干燥直接称量 D、称量沉淀质量时,砝码与药品位置放反了28. 金属与酸反应会放出热量。为深入研究金属和酸反应的特点,小明用如图甲所示装置进行实验:在烧瓶中加入0.48克镁和足量的溶质质量分数为的稀盐酸,塞紧瓶塞,利用传感器记录160秒内瓶内气压变化。用等质量的铁和锌重复上述实验,得到相关曲线如图乙。 (1)、图乙中,能支持锌比铁活动性强的证据是。(2)、实验中,若0.48克镁完全反应,至少需要稀盐酸多少克?(镁与盐酸反应的化学方程式为:)(3)、解释镁与稀盐酸反应,0~80秒瓶内气压发生如图乙变化的原因:。
(1)、图乙中,能支持锌比铁活动性强的证据是。(2)、实验中,若0.48克镁完全反应,至少需要稀盐酸多少克?(镁与盐酸反应的化学方程式为:)(3)、解释镁与稀盐酸反应,0~80秒瓶内气压发生如图乙变化的原因:。