山东省淄博市淄川一中2016-2017学年高一上学期化学期中考试试卷
试卷日期:2017-10-16 考试类型:期中考试
一、选择题
-
1. 某实验小组只领取下列仪器或用品:铁架台、铁圈、铁夹、三角架、石棉网、烧杯、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、火柴、滤纸、漏斗.只应用上述仪器或用品,不能进行的实验操作是( )A、蒸发 B、萃取 C、过滤 D、蒸馏2. 完成下列实验所选择的装置或仪器不正确的是( )
A
B
C
D
实 验
实验分离水和酒精
用铵盐和碱制取氨气
用排空气法收集二氧化氮
用自来水制取蒸馏水
装置或仪器
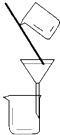
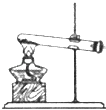
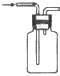
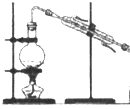 A、A B、B C、C D、D3. 下列反应的离子方程式正确的是( )A、铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ B、用小苏打 (NaHCO3)治疗胃酸过多:HCO3﹣+H+═H2O+CO2↑ C、往碳酸镁中滴加稀盐酸:CO32﹣+2H+═H2O+CO2↑ D、氢氧化钡溶液与稀H2SO4反应:Ba2++SO42﹣+H++OH﹣═BaSO4↓+H2O4. 下列有关试验的做法不正确的是( )A、分液时,分液漏斗的上层液体应由上口到出 B、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 C、配置0.1000mol•L﹣1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 D、锥形瓶用作反应容器时可以加热5. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、标准状况下,22.4LCCl4含有NA个分子 B、0.1mol/L的HNO3中有0.1NA个H+ C、常温常压下,8gO2含有4NA个电子 D、1molNa被完全氧化生成Na+ , 失去2NA个电子6. 下列实验装置或操作与粒子的大小无直接关系的是( )A、
A、A B、B C、C D、D3. 下列反应的离子方程式正确的是( )A、铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ B、用小苏打 (NaHCO3)治疗胃酸过多:HCO3﹣+H+═H2O+CO2↑ C、往碳酸镁中滴加稀盐酸:CO32﹣+2H+═H2O+CO2↑ D、氢氧化钡溶液与稀H2SO4反应:Ba2++SO42﹣+H++OH﹣═BaSO4↓+H2O4. 下列有关试验的做法不正确的是( )A、分液时,分液漏斗的上层液体应由上口到出 B、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 C、配置0.1000mol•L﹣1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 D、锥形瓶用作反应容器时可以加热5. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、标准状况下,22.4LCCl4含有NA个分子 B、0.1mol/L的HNO3中有0.1NA个H+ C、常温常压下,8gO2含有4NA个电子 D、1molNa被完全氧化生成Na+ , 失去2NA个电子6. 下列实验装置或操作与粒子的大小无直接关系的是( )A、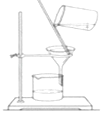 过滤
B、
过滤
B、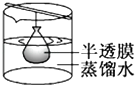 渗析
C、
渗析
C、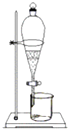 萃取
D、
萃取
D、 丁达尔效应
7. 某校化学兴趣小组在实验中发现一瓶溶液.标签上标有“CaCl2 0.1mol•L﹣1”的字样,下面是该小组成员对溶液的叙述,正确的是( )A、配制1L该溶液,可将0.1mol CaCl2溶于1L水中 B、Ca2+和Cl﹣的物质的量浓度都是0.1mol•L﹣1 C、从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.05mol•L﹣1 D、将该瓶溶液稀释一倍,则所得溶液的c(Cl﹣)为0.1mol•L﹣18. 在某无色透明的酸性溶液中,能共存的离子组是( )A、Na+K+ SO42﹣ HCO3﹣ B、Cu2+ K+ SO42﹣ NO3﹣ C、Na+ K+ Cl﹣ NO3﹣ D、Al3+ K+ SO42﹣OH﹣9. 下列各组微粒中,在一定条件下均可以做氧化剂的是( )A、F﹣ , Br﹣ , S2﹣ B、Fe3+ , MnO4﹣ , NO3﹣ C、Cl2 , HClO,Mg D、ClO﹣ , Cl﹣ , Ag+10. 氧化还原反应的实质是( )A、原子重新组合 B、有氧元素参加 C、元素化合价发生变化 D、电子的转移(得失或偏移)11. 下列变化中必须加入氧化剂才能发生的是( )A、Na2O→NaOH B、Fe→FeCl2 C、CuO→Cu D、H2O2→H2O12. 已知有如下反应:①2BrO3﹣+Cl2═Br2+2ClO3﹣ , ②ClO3﹣+5Cl﹣+6H+═3Cl2+3H2O,③2FeCl3+2KI═2FeCl2+2KCl+I2 , ④2FeCl2+Cl2═2FeCl3 . 下列各微粒氧化能力由强到弱的顺序正确的是( )A、ClO3﹣>BrO3﹣>Cl2>Fe3+>I2 B、BrO3﹣>Cl2>ClO3﹣>I2>Fe3+ C、BrO3﹣>ClO3﹣>Cl2>Fe3+>I2 D、BrO3﹣>ClO3﹣>Fe3+>Cl2>I213. 宋代著名法医学家宋慈的《洗冤集录》中有﹣银针验毒的记载,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列说法正确的是( )A、X的化学式为AgS B、银针验毒时,空气中氧气失去电子 C、反应中Ag和H2S均是还原剂 D、每生成1molX,反应转移2mo1 e﹣14. 下列反应中,氧化剂与还原剂化学计量数为1:2的是( )A、Fe+2HCl═FeCl2+H2↑ B、2HCl+Ca(ClO)2═2HClO+CaCl2 C、I2+2NaClO3═2NaIO3+Cl2↑ D、4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
丁达尔效应
7. 某校化学兴趣小组在实验中发现一瓶溶液.标签上标有“CaCl2 0.1mol•L﹣1”的字样,下面是该小组成员对溶液的叙述,正确的是( )A、配制1L该溶液,可将0.1mol CaCl2溶于1L水中 B、Ca2+和Cl﹣的物质的量浓度都是0.1mol•L﹣1 C、从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.05mol•L﹣1 D、将该瓶溶液稀释一倍,则所得溶液的c(Cl﹣)为0.1mol•L﹣18. 在某无色透明的酸性溶液中,能共存的离子组是( )A、Na+K+ SO42﹣ HCO3﹣ B、Cu2+ K+ SO42﹣ NO3﹣ C、Na+ K+ Cl﹣ NO3﹣ D、Al3+ K+ SO42﹣OH﹣9. 下列各组微粒中,在一定条件下均可以做氧化剂的是( )A、F﹣ , Br﹣ , S2﹣ B、Fe3+ , MnO4﹣ , NO3﹣ C、Cl2 , HClO,Mg D、ClO﹣ , Cl﹣ , Ag+10. 氧化还原反应的实质是( )A、原子重新组合 B、有氧元素参加 C、元素化合价发生变化 D、电子的转移(得失或偏移)11. 下列变化中必须加入氧化剂才能发生的是( )A、Na2O→NaOH B、Fe→FeCl2 C、CuO→Cu D、H2O2→H2O12. 已知有如下反应:①2BrO3﹣+Cl2═Br2+2ClO3﹣ , ②ClO3﹣+5Cl﹣+6H+═3Cl2+3H2O,③2FeCl3+2KI═2FeCl2+2KCl+I2 , ④2FeCl2+Cl2═2FeCl3 . 下列各微粒氧化能力由强到弱的顺序正确的是( )A、ClO3﹣>BrO3﹣>Cl2>Fe3+>I2 B、BrO3﹣>Cl2>ClO3﹣>I2>Fe3+ C、BrO3﹣>ClO3﹣>Cl2>Fe3+>I2 D、BrO3﹣>ClO3﹣>Fe3+>Cl2>I213. 宋代著名法医学家宋慈的《洗冤集录》中有﹣银针验毒的记载,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列说法正确的是( )A、X的化学式为AgS B、银针验毒时,空气中氧气失去电子 C、反应中Ag和H2S均是还原剂 D、每生成1molX,反应转移2mo1 e﹣14. 下列反应中,氧化剂与还原剂化学计量数为1:2的是( )A、Fe+2HCl═FeCl2+H2↑ B、2HCl+Ca(ClO)2═2HClO+CaCl2 C、I2+2NaClO3═2NaIO3+Cl2↑ D、4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O二、填空题
-
15. 下列数量的各物质所含原子数按由大到小顺序排列的是
①0.5molNH3 ②标况下22.4LHe ③4℃时36mL水 ④0.8molH3PO4 .
16. 现有m g某气体,它是三原子分子,其摩尔质量为M g•mol﹣1 . 若阿伏加德罗常数用NA表示,请用以符号及相应数字填写下列空格.
①该气体的物质的量为mol.
②该气体所含原子总数为个.
③该气体在标准状况下的体积为L.
④该气体完全溶于水形成V L溶液(不考虑反应),所得溶液的物质的量浓度为mol•L﹣1 .
17. 某氧化还原反应中反应物与生成物有:AsH3、H2SO4、KIO3、K2SO4、H3AsO4、H2O、I2 . 已知KIO3之发生反应KIO3→I2(1)、则该反应的还原剂是 , 氧化剂是 .(2)、该反应中,发生氧化反应的过程是→ .(3)、根据上述反应可推知 .a.氧化性:KIO3>H3AsO4 b.氧化性:H3AsO4>KIO3 c.还原性:AsH3>I2 d.还原性:I2>AsH3 .
18. 实验需要0.1mol•L﹣1的 NaOH溶液500mL,其操作有以下各步:①用托盘天平称量NaOH的质量
②洗涤烧杯和玻璃棒2﹣3次,将洗涤液转入容量瓶中
③将冷却后的氢氧化钠溶液转移入容量瓶中
④将NaOH倒入烧杯中用水溶解、冷却
⑤加水至液面接近刻度线1~2cm处,定容,摇匀
完成下列填空:
(1)、实验中除了托盘天平、烧杯、玻璃棒外还需要的其他仪器有 .(2)、根据计算得知,所需NaOH的质量为g.(3)、正确的操作顺序是(用序号填写)(4)、配制过程中,下列情况会使配制结果偏低的是 .①定容时俯视刻度线观察液面
②未经冷却就进行转移操作
③移液时未洗涤烧杯和玻璃棒
④定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线.
(5)、若取50.0mL上述已配好的溶液,与另一150mL0.2mol/L的NaOH溶液混合,最后得到的溶液的物质的量浓度为(设溶液的体积变化可忽略).19. Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42﹣ , 需要分离提纯.现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸;②Na2CO3;③NaOH;④BaCl2来逐一除去食盐水中Ca2+、Mg2+、SO42﹣ . 提纯的操作步骤和加入试剂的情况如图: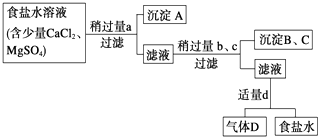
图中a、b、c、d分别表示上述4种试剂中的一种,试回答:
(1)、沉淀A的名称是;(2)、试剂d是;判断试剂d已经足量的方法是;(3)、现有下列仪器,过滤出沉淀A、B、C时必须用到(填序号),仪器③的名称是 .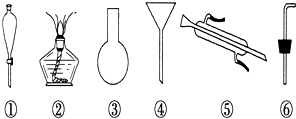 (4)、Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的一部分,则正确的是(填序号).(5)、Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的 (填序号),该仪器名称为 , 向该碘水中加入四氯化碳以提取碘单质的实验操作为 .
(4)、Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的一部分,则正确的是(填序号).(5)、Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的 (填序号),该仪器名称为 , 向该碘水中加入四氯化碳以提取碘单质的实验操作为 .