山东省临沂市蒙阴一中2016-2017学年高二上学期化学期中考试试卷
试卷日期:2017-09-30 考试类型:期中考试
一、选择题
-
1. 下列试剂中,标签上应同时标注下列标志的是( )
 A、乙醇 B、盐酸 C、NaOH D、HNO32. 下列说法正确的是( )A、硫酸的摩尔质量是98 g B、氯原子的摩尔质量等于氯的相对原子质量 C、标准状况下,任何物质的摩尔体积都约是22.4 L D、1 mol氧气的质量为32 g3. 氯化铁溶液与氢氧化铁胶体具有的共同性质是( )A、分散质颗粒直径都在1~100nm之间 B、能透过半透膜 C、加入浓氢氧化钠溶液都产生红褐色沉淀 D、颜色都呈红褐色4. 下表表示一些物质或概念间的从属关系,不正确的是( )
A、乙醇 B、盐酸 C、NaOH D、HNO32. 下列说法正确的是( )A、硫酸的摩尔质量是98 g B、氯原子的摩尔质量等于氯的相对原子质量 C、标准状况下,任何物质的摩尔体积都约是22.4 L D、1 mol氧气的质量为32 g3. 氯化铁溶液与氢氧化铁胶体具有的共同性质是( )A、分散质颗粒直径都在1~100nm之间 B、能透过半透膜 C、加入浓氢氧化钠溶液都产生红褐色沉淀 D、颜色都呈红褐色4. 下表表示一些物质或概念间的从属关系,不正确的是( )X
Y
Z
A
氧化物
化合物
纯净物
B
中和反应
复分解反应
氧化还原反应
C
胶体
分散系
混合物
D
强酸
电解质
化合物
A、A B、B C、C D、D5. 下列说法正确的是( )A、Al2O3固体不导电且难溶于水,所以Al2O3不是电解质 B、Na2SO4溶液导电,所以Na2SO4是电解质 C、纯净的硫酸不导电,所以硫酸不是电解质 D、1.5mol/L的NaCl溶液与1.0mol/L的MgCl2溶液相比较,导电能力后者强6. 下列反应中,不属于氧化还原反应的是( )A、H2+F2═2HF B、3CO+Fe2O3 2Fe+3CO2 C、NaOH+HCl═NaCl+H2O D、4HNO3 2H2O+4NO2↑+O2↑7. 下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )A、Fe3+、K、Fe2+ B、Cl﹣、Al、H2 C、NO2、Na+、Br2 D、O2、SO2、Fe8. 下列离子方程式书写正确的是( )A、稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ B、铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag C、碳酸钙与盐酸反应:CO32﹣+2H+=CO2↑+H2O D、Ba(OH)2与CuSO4溶液反应:Cu2++SO42﹣+Ba2++2OH﹣=BaSO4↓+Cu(OH)2↓9. 下列物质转化关系中,需要加入适当氧化剂的是( )A、PCl3→PCl5 B、MnO4﹣→Mn2+ C、SO3→SO42﹣ D、CO2→CO10. 在一定条件下,RO3n﹣和F2可发生如下反应:RO3n﹣+F2+2OH﹣═RO4﹣+2F﹣+H2O,从而可知在RO3n﹣中,元素R的化合价是( )A、+4 B、+5 C、+6 D、+711. 下列实验操作或装置(略去部分夹持仪器)正确的是( )A、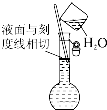 配制溶液
B、
配制溶液
B、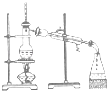 分离乙醇和水
C、
分离乙醇和水
C、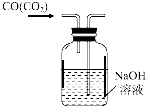 除去CO气体中的CO2
D、
除去CO气体中的CO2
D、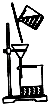 除去粗盐中的不溶物
12. 下列实验操作中,正确的是( )A、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 B、用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 C、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 D、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中13. 在强酸性无色透明溶液中,下列各组离子能大量共存的是( )A、Cu2+、K+、Cl﹣、NO3﹣ B、Ag+、Na+、NO3﹣、Cl﹣ C、Na+、Al3+、SO42﹣、Cl﹣ D、Ba2+、NH4+、Cl﹣、CO32﹣14. 下列物质的分类合理的是( )A、电解质:CO2、Ca(OH)2、H2O,HNO3 B、碱:NaOH,Ba(OH)2、Na2CO3、NH3•H2O C、碱性氧化物:CaO,Na2O,FeO,Mn2O7 D、盐:NH4NO3、KAl(SO4)2、NH4Cl、NaHCO315. 已知同温同压下,CO和NO的体积相同,则下列物理量一定不相同的是( )A、分子数 B、原子数 C、物质的量 D、质量16. 下列对实验过程的评价正确的是( )A、某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3 B、某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42﹣ C、某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性 D、验证烧碱溶液中是否含有Cl﹣ , 先加稀盐酸除去OH﹣ , 再加硝酸银溶液,有白色沉淀出现,证明含Cl﹣17. 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,22.4LCO2含有的分子数为1NA B、常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA C、通常状况下,NA个CO2分子占有的体积约为22.4L D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为1NA18. 根据下列反应判断有关的物质氧化性由强到弱的顺序是( )
除去粗盐中的不溶物
12. 下列实验操作中,正确的是( )A、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 B、用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 C、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 D、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中13. 在强酸性无色透明溶液中,下列各组离子能大量共存的是( )A、Cu2+、K+、Cl﹣、NO3﹣ B、Ag+、Na+、NO3﹣、Cl﹣ C、Na+、Al3+、SO42﹣、Cl﹣ D、Ba2+、NH4+、Cl﹣、CO32﹣14. 下列物质的分类合理的是( )A、电解质:CO2、Ca(OH)2、H2O,HNO3 B、碱:NaOH,Ba(OH)2、Na2CO3、NH3•H2O C、碱性氧化物:CaO,Na2O,FeO,Mn2O7 D、盐:NH4NO3、KAl(SO4)2、NH4Cl、NaHCO315. 已知同温同压下,CO和NO的体积相同,则下列物理量一定不相同的是( )A、分子数 B、原子数 C、物质的量 D、质量16. 下列对实验过程的评价正确的是( )A、某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3 B、某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42﹣ C、某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性 D、验证烧碱溶液中是否含有Cl﹣ , 先加稀盐酸除去OH﹣ , 再加硝酸银溶液,有白色沉淀出现,证明含Cl﹣17. 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,22.4LCO2含有的分子数为1NA B、常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA C、通常状况下,NA个CO2分子占有的体积约为22.4L D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为1NA18. 根据下列反应判断有关的物质氧化性由强到弱的顺序是( )H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3 .
A、H2SO3>I﹣>Fe2+>NO B、HNO3>Fe3+>I2>H2SO4 C、HNO3>Fe3+>H2SO3>I2 D、NO>Fe2+>H2SO3>I﹣二、填空题
-
19. 按要求填空:
(1)、稀硫酸跟氧化镁反应(写出离子方程式)(2)、盐酸跟碳酸氢钠溶液反应(写出离子方程式)(3)、Cu2++2OH﹣=Cu(OH)2↓(写出化学方程式)(4)、氢氧化铁胶体制备(写出化学方程式) .20. 现有下列十种物质:①液态HCl ②NaHCO3③NaCl溶液 ④CO2⑤蔗糖晶体 ⑥Ba(OH)2⑦红褐色的氢氧化铁胶体 ⑧NH3⑨空气 ⑩Al2(SO4)3(1)、上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH﹣═H2O,该反应的化学方程式为 .(2)、⑩在水中的电离方程式为 ,(3)、胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水.医生常用胃舒平(主要成分氢氧化铝)来治疗,它与胃酸反应的离子方程式: .(4)、上述十种物质中属于电解质的是: . (填序号)21. 阅读、分析下列两个材料:材料一:如图
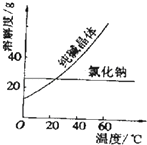
材料二:如表
物质
熔点/℃
沸点/℃
密度/g•cm﹣3
溶解性
乙二醇C2H6O2
﹣11.5
198
1.11
易溶于水和乙醇
丙三醇C3H8O3
17.9
290
1.26
跟水、酒精以任意比互溶
根据上述材料及课本知识,回答下列问题(每空只填一个字母选项,):
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
(1)、分离汽油和水的最佳方法是;(2)、去除纯碱中的少量氯化钠杂质,最好应用;(3)、将乙二醇和丙三醇相互分离的最佳方法是 .22. 某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42﹣ .Ⅰ某校研究性学习小组设计如图流程以回收铜和硫酸亚铁.请回答:
 (1)、反应①的离子方程式为 .(2)、操作①中用到的玻璃仪器是(填序号).
(1)、反应①的离子方程式为 .(2)、操作①中用到的玻璃仪器是(填序号).a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(3)、固体成分是(填名称).(4)、原料②的名称为 .(5)、Ⅱ回收的铜可用于制备胆矾(CuSO4•5H2O).,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2 2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.①请分析2Cu+2H2SO4+O2 2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
②用双线桥标出上述反应的电子得失 .
三、实验题
-
23. 碘是人体不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去.某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:在溶液中 KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4(1)、用双线桥表示该反应中电子转移的方向和数目:该反应中氧化产物与还原产物的质量比是 , 0.1mol KIO3参加反应时转移电子mol(2)、实验结束后分离I2和K2SO4溶液所用的试剂是
A.Na2SO4溶液B.酒精 C. CCl4 D.食盐水
所用的分离方法是 , 所用仪器是 , 你怎么判断该食盐中是否含碘 .
(3)、上面实验中用到一定物质的量浓度的稀硫酸,若配制1mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4mL,配制中需要用到的主要玻璃仪器是(填序号) .A.100mL量筒 B.托盘天平 C.玻璃棒D.100mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)、下面操作造成所配稀硫酸溶液浓度偏高的是A、溶解后溶液没有冷却到室温就转移 B、转移时没有洗涤烧杯、玻璃棒 C、向容量瓶加水定容时眼睛俯视液面 D、用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶 E、摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.四、推断题
-
24. 有一瓶溶液只含Cl﹣、CO32﹣、SO42﹣、Na+、Mg2+、Cu2+六种离子中的某几种,通过实验:
①原溶液加过量的NaOH溶液,产生白色沉淀;
②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,回答下列问题:
(1)、试分析原溶液中一定含有的离子是 , 一定不含有的离子是 , 可能含有的离子是;(2)、有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”),理由是;(3)、若溶液中确定有Na+ , 若溶液中c(Mg2+)=0.1mol/L,c(Cl﹣)=0.3mol/L,则c(Na+)= .(4)、进行①操作后,过滤所得溶液中一定有的溶质是 .
-