2020高考化学常考知识点专练 08:电解质溶液
试卷日期:2020-06-01 考试类型:一轮复习
一、单选题
-
1. 在指定条件下,下列各组离子一定能大量共存的是( )A、滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- B、滴入KSCN显血红色的溶液中:NH4+、Al3+、NO3-、SO42- C、c(OH-)/c(H+)=1012的溶液中:NH4+、K+、Cl-、HCO3- D、由水电离的c(H+)=1.0×10-13 mol·L-1溶液中:K+、Al3+、SO42-、CH3COO-2. 25℃时,将0.1mol·L-1氨水溶液加水稀释,下列数值变大的是( )A、c(OH-) B、pH C、Kb D、n(H+)·n(OH-)3. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 实验 现象 结论 A 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 有气体生成,溶液呈血红色 硝酸将Fe2+氧化为Fe3+ B 将铜粉加入1.0mol/LFe2(SO4)3溶液中 溶液变蓝,有黑色固体出现 金属铁比铜活泼 C 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 熔化后的液态铝滴落下来 金属铝的熔点较低 D 将0.1mol/LMgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 先有白色沉淀生成,后变为浅蓝色沉淀 Cu(OH)2的溶度积比Mg(OH)2的小 A、A B、B C、C D、D4. 室温下,将0.100 0 mol·L-1盐酸滴入20.00 mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示。下列有关说法不正确的是( )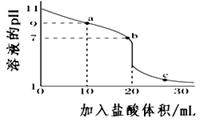 A、该一元碱溶液浓度为0.100 0 mol·L-1 B、a点:c(M+) >c(Cl-)> c(OH-)> c(H+) C、b点:c(M+)+c(MOH)=c(Cl-) D、室温下,MOH的电离常数Kb=1×10-55. PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如下图所示。
A、该一元碱溶液浓度为0.100 0 mol·L-1 B、a点:c(M+) >c(Cl-)> c(OH-)> c(H+) C、b点:c(M+)+c(MOH)=c(Cl-) D、室温下,MOH的电离常数Kb=1×10-55. PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如下图所示。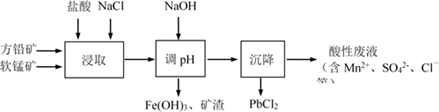
已知:i. PbCl2微溶于水
ii. PbCl2 (s) + 2Cl-(aq) PbCl42-(aq) ΔH > 0
下列说法不正确的是( )
A、浸取过程中MnO2与PbS发生反应的离子方程式为:8H++2Cl-+PbS + 4MnO2 = PbCl2 +4Mn2++SO42-+4H2O B、PbCl2微溶于水,浸取剂中加入饱和NaCl溶液会增大其溶解性 C、调pH的目的是除去Fe3+ , 因此pH越大越好 D、沉降池中获得PbCl2采取的措施有加水稀释、降温6. 用一定浓度 NaOH 溶液滴定某醋酸溶液。滴定终点附近溶液 pH 和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点;溶液总体积变化忽略不计)。下列说法不正确的是( )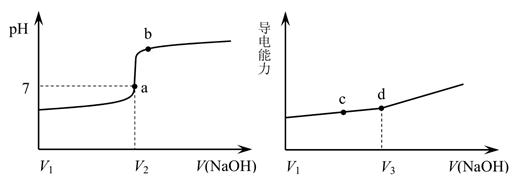 A、a 点对应的溶液中:c(CH3COO-) = c(Na+) B、a→b 过程中,n(CH3COO-)不断增大 C、c→d 溶液导电性增强的主要原因是 c(OH-)和 c(Na+)增大 D、根据溶液 pH 和导电能力的变化可判断:V2<V37. 某温度下,向10 mL 0.1 mol/L CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法不正确的是( )
A、a 点对应的溶液中:c(CH3COO-) = c(Na+) B、a→b 过程中,n(CH3COO-)不断增大 C、c→d 溶液导电性增强的主要原因是 c(OH-)和 c(Na+)增大 D、根据溶液 pH 和导电能力的变化可判断:V2<V37. 某温度下,向10 mL 0.1 mol/L CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法不正确的是( )(已知:Ksp(ZnS)=3×10-25mol2/L2)
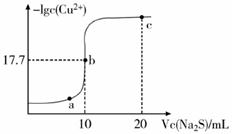 A、a、b、c三点中,水的电离程度最大的为b点 B、Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+) C、该温度下Ksp(CuS)=10-35.4 mol2/L2 D、向100 mL Zn2+、Cu2+浓度均为10-5 mol/L的混合溶液中逐滴加入10-4 mol/L的Na2S溶液,Cu2+先沉淀8. 草酸(H2C2O4)是二元弱酸,NaHC2O4溶液呈酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系错误的是( )A、V(NaOH)=0时,c(H+)>1×10-7mol/L B、V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) C、V(NaOH)=10mL时,溶液的pH为9,则10-9=10-5-2c(H2C2O4)-c(HC2O4-) D、V(NaOH)>10mL时,可能存在c(OH-)>c(Na+)>c(C2O42-)9. 下列溶液中有关物质的量浓度关系不正确的是( )A、pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(CH3COONa)<c(NaHCO3) B、已知259℃时Ksp(AgCl)=1.8×10-10 , 则在0.3 mol·L-1 NaCl溶液中,Ag+的物质的量浓度最大可达到6.0×10-10 mol·L-1 C、25℃时,0.1 mol·L-1 Na2CO3溶液中水电离出来的c(OH)大于0.1 mol·L-1 NaOH溶液中水电离出来的c(OH-) D、浓度均为0.1 mol/L的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=c(CH2COOH)+2c(H+)10. 下列有关电解质溶液的说法正确的是( )A、向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小 B、CH3COONa溶液从20℃升温至30℃,溶液中 增大 C、向0.1 mol·L-1氨水中加入少量硫酸铵固体,溶液中 增大 D、向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中 不变11. 25℃时,水的电离达到平衡:H2O H++ OH- ΔH > 0 ,下列叙述正确的是( )A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B、向水中加入少量固体NaHSO4 , c(H+)增大,Kw不变 C、向水中加入少量固体CH3COONa ,平衡逆向移动,c(H+)降低 D、将水加热,Kw增大,pH不变
A、a、b、c三点中,水的电离程度最大的为b点 B、Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+) C、该温度下Ksp(CuS)=10-35.4 mol2/L2 D、向100 mL Zn2+、Cu2+浓度均为10-5 mol/L的混合溶液中逐滴加入10-4 mol/L的Na2S溶液,Cu2+先沉淀8. 草酸(H2C2O4)是二元弱酸,NaHC2O4溶液呈酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系错误的是( )A、V(NaOH)=0时,c(H+)>1×10-7mol/L B、V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) C、V(NaOH)=10mL时,溶液的pH为9,则10-9=10-5-2c(H2C2O4)-c(HC2O4-) D、V(NaOH)>10mL时,可能存在c(OH-)>c(Na+)>c(C2O42-)9. 下列溶液中有关物质的量浓度关系不正确的是( )A、pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)<c(CH3COONa)<c(NaHCO3) B、已知259℃时Ksp(AgCl)=1.8×10-10 , 则在0.3 mol·L-1 NaCl溶液中,Ag+的物质的量浓度最大可达到6.0×10-10 mol·L-1 C、25℃时,0.1 mol·L-1 Na2CO3溶液中水电离出来的c(OH)大于0.1 mol·L-1 NaOH溶液中水电离出来的c(OH-) D、浓度均为0.1 mol/L的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=c(CH2COOH)+2c(H+)10. 下列有关电解质溶液的说法正确的是( )A、向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小 B、CH3COONa溶液从20℃升温至30℃,溶液中 增大 C、向0.1 mol·L-1氨水中加入少量硫酸铵固体,溶液中 增大 D、向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中 不变11. 25℃时,水的电离达到平衡:H2O H++ OH- ΔH > 0 ,下列叙述正确的是( )A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B、向水中加入少量固体NaHSO4 , c(H+)增大,Kw不变 C、向水中加入少量固体CH3COONa ,平衡逆向移动,c(H+)降低 D、将水加热,Kw增大,pH不变二、综合题
-
12. 以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2 , 实现锰的再利用。其工作流程如下:
 (1)、过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。
(1)、过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是。
(2)、溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。① 溶液a呈酸性,原因是。
② 根据下图所示的溶解度曲线,将溶液a (填操作名称),可得NH4Cl粗品。
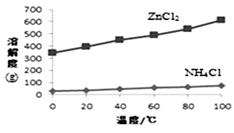
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物
ZnCl2
NH4Cl
熔点
365℃
337.8℃分解
沸点
732℃
根据上表,设计方案提纯NH4Cl:
(3)、检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入(填试剂和现象),证明溶液中Fe3+沉淀完全。(4)、探究过程Ⅱ中MnO2溶解的适宜条件。ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4 , 固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4 , 固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:。
② 解释试剂加入顺序不同,MnO2作用不同的原因:
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
13. 铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下: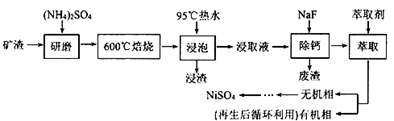
已知(NH4)2SO4在350℃分解生成NH3和H2SO4 , 回答下列问题:
(1)、“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有(写化学式)。(2)、矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为(3)、向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为[Ksp(CaF2)=4.0×10-11]。(4)、溶剂萃取可用于对溶液中的金属离子进行富集与分离: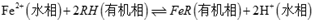 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图甲所示,V0/VA的最佳取值为。在(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图甲所示,V0/VA的最佳取值为。在(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。 
图甲 图乙
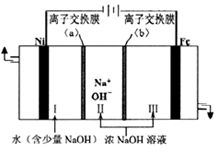
(5)、以Fe、Ni为电极制取Na2FeO4的原理如图乙所示。通电后,在铁电极附近生成紫红色的FeO42- , 若pH过高,铁电极区会产生红褐色物质。①电解时阳极的电极反应式为 , 离子交换膜(b))为(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为。
14. 水是生命之源,万物之基。不仅如此,水在化学中的作用也不可忽视。(1)、I.常温下,浓度均为0.1 mol·L-1的下列五种水溶液的pH如下表:
上述盐溶液中的阴离子,结合质子能力最强的是。
(2)、根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最弱的是;将各溶液分别加水稀释100倍,pH变化最大的是(填字母)。A.HCN B.HClO C.H2CO3 D.CH3COOH
(3)、要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为。(4)、II.已知水在25℃和95℃时,其电离平衡曲线如图所示: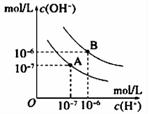
95℃时水的电离平衡曲线应为(选填“A”或“B”);
(5)、25℃时,将pH=10的NaOH溶液与pH=6的盐酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与盐酸溶液的体积比为;(6)、95℃时,若1体积pH=a的某强酸溶液与10x体积pH=b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是。15. 火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。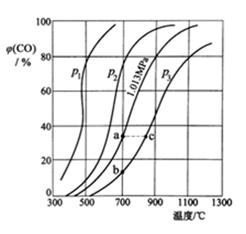 (1)、脱硝。利用甲烷催化还原NOx:
(1)、脱硝。利用甲烷催化还原NOx:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式:。
(2)、脱碳。方法一:在恒容密闭容器中将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
①下列条件可以判定该反应到达平衡状态的是(填字母)。
A.2v正(H2)=v逆(CH3OH) B.容器内气体的密度不变
C.容器内压强不变 D.反应不再释放热量
方法二:让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) 2CO(g) ∆H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
② 图中p1、p2、p3的大小关系是 , 图中a、b、c三点对应的平衡常数Ka、Kb、Kc大小关系是。
③ 900 ℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V L,CO2的转化率为(保留一位小数),该反应的平衡常数K=。
方法三:用NaOH溶液吸收CO2。
④在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO32-):c(CO32-)=4:1,此时溶液的pH=。(已知:室温下,H2CO3的K1=4×10-7 , K2=5×10-11。lg2=0.3)
(3)、脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成(NH4)2SO4。(NH4)2SO4水溶液呈酸性的原因是(用离子方程式表示);室温时,向(NH4)2SO4溶液中滴入NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)c(NH3·H2O)(填“>”、“<”或“=”)。16. 以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下: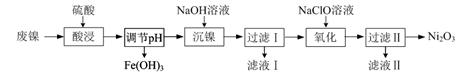 (1)、“酸浸”时为了提高酸浸的速率(浸取率),可采取的措施有(任写出一条)。(2)、“酸浸”时Fe2O3发生反应的离子方程式:。(3)、“调节pH”使溶液中的Fe3+沉淀完全(离子浓度≤10-5 mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于 [已知Fe(OH)3的Ksp=4×10-38 , ≈1.6 ]。(4)、“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是。(5)、“滤液Ⅱ”所含阴离子主要为Cl- , 写出“氧化”时反应的离子方程式:。(6)、以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的 。电解时阳极的电极反应式为 , 离子交换膜(b)为(填“阴”或“阳”)离子交换膜。
(1)、“酸浸”时为了提高酸浸的速率(浸取率),可采取的措施有(任写出一条)。(2)、“酸浸”时Fe2O3发生反应的离子方程式:。(3)、“调节pH”使溶液中的Fe3+沉淀完全(离子浓度≤10-5 mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于 [已知Fe(OH)3的Ksp=4×10-38 , ≈1.6 ]。(4)、“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是。(5)、“滤液Ⅱ”所含阴离子主要为Cl- , 写出“氧化”时反应的离子方程式:。(6)、以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的 。电解时阳极的电极反应式为 , 离子交换膜(b)为(填“阴”或“阳”)离子交换膜。