2020高考化学常考知识点专练 07:化学平衡
试卷日期:2020-06-01 考试类型:一轮复习
一、单选题
-
1. 对于可逆反应A(g)+3B(g) 2C(g)+D(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )A、v(A)=0.1mol·L-1·s-1 B、v(B)=0.6mol·L-1·s-1 C、v(C)=0.9 mol·L-1 min-1 D、υ(D)=1.2mol·L-1·min-12. 下列图示与对应叙述相符的是( )
 A、图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化 B、图②表示压强对可逆反应A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 C、图③中曲线表示反应3A(g) + B(g) 2C(g)△H<0,正、逆反应的平衡常数K随温度的变化 D、据图④,若要除去CuSO4溶液中的Fe3+ , 可加入NaOH溶液至pH在4左右3. 在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g) 2 H2(g) + O2(g) ∆H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
A、图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化 B、图②表示压强对可逆反应A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 C、图③中曲线表示反应3A(g) + B(g) 2C(g)△H<0,正、逆反应的平衡常数K随温度的变化 D、据图④,若要除去CuSO4溶液中的Fe3+ , 可加入NaOH溶液至pH在4左右3. 在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g) 2 H2(g) + O2(g) ∆H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:序号
时间/min
0
10
20
30
40
60
①
温度T1 / 1号Cu2O
0.0500
0.0492
0.0486
0.0482
0.0480
0.0480
②
温度T1 / 2号Cu2O
0.0500
0.0490
0.0483
0.0480
0.0480
0.0480
③
温度T2 / 2号Cu2O
0.0500
0.0480
0.0470
0.0470
0.0470
0.0470
下列说法不正确的是( )
A、实验时的温度T2高于T1 B、2号Cu2O的催化效率比1号Cu2O的催化效率高 C、实验①前20 min的平均反应速率v(O2) = 7×10ˉ5 mol·Lˉ1·minˉ1 D、等质量纳米级Cu2O比微米级Cu2O催化效率高,这与Cu2O的粒径大小有关4. 温度为T时,向VL的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g) C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示。下列说法中不正确的是( )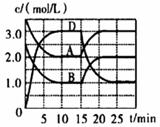 A、反应在前10min以B物质表示的平均反应速率v(B)=0.15 mol·L-1·min-1 B、该反应方程式中的x=2 C、若平衡时保持温度不变,压缩容器容积,平衡向逆反应方向移动 D、反应至15min时,改变的条件是降低温度5. 根据相应的图象(图象编号与选项一一对应),判断下列相关说法正确的是( )
A、反应在前10min以B物质表示的平均反应速率v(B)=0.15 mol·L-1·min-1 B、该反应方程式中的x=2 C、若平衡时保持温度不变,压缩容器容积,平衡向逆反应方向移动 D、反应至15min时,改变的条件是降低温度5. 根据相应的图象(图象编号与选项一一对应),判断下列相关说法正确的是( ) A、t0时改变某一条件后如图所示,则改变的条件一定是加入催化剂 B、反应达到平衡时,外界条件对平衡的影响如图所示,则正反应为放热反应 C、从加入反应物开始,物质的百分含量与温度的关系如图所示,则该反应的正反应为放热反应 D、反应速率随反应条件的变化如图所示,则该反应的正反应为放热反应,A,B,C一定均为气体,D为固体或液体6. 在恒容绝热密闭容器中发生CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g),下列情况都能说明该反应已达到平衡状态的是( )
A、t0时改变某一条件后如图所示,则改变的条件一定是加入催化剂 B、反应达到平衡时,外界条件对平衡的影响如图所示,则正反应为放热反应 C、从加入反应物开始,物质的百分含量与温度的关系如图所示,则该反应的正反应为放热反应 D、反应速率随反应条件的变化如图所示,则该反应的正反应为放热反应,A,B,C一定均为气体,D为固体或液体6. 在恒容绝热密闭容器中发生CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g),下列情况都能说明该反应已达到平衡状态的是( )①容器内混合气体的平均相对分子质量不再变化; ②容器内气体分子个数不再发生变化;
③容器内气体的压强不再发生变化; ④v正(NO):v逆(N2):V逆(CO2)=4:2:1
A、①②③ B、③④ C、①②③④ D、②③④7. T0℃时,在2 L的密闭容器中发生反应:X(g)+Y(g) Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )  A、该反应的正反应是吸热反应 B、T1℃时,若该反应的平衡常数K=50,则T1<T0 C、图a中反应达到平衡时,Y的转化率为37.5 % D、T0℃,从反应开始到平衡时:v(X)=0.083 mol·L-1·min-18. 在固定容积的密闭容器中,A和B发生下列反应:A(S)+2B(g) 2C(g) △H>0,在一定条件下达到平衡,若升高温度则达平衡后混合气体的( )A、气体的分子数减少 B、A的物质的量浓度减小 C、气体的密度减小 D、气体的平均相对分子质量增大9. 用过量铁块与稀硫酸反应制取氢气,采取下列措施:
A、该反应的正反应是吸热反应 B、T1℃时,若该反应的平衡常数K=50,则T1<T0 C、图a中反应达到平衡时,Y的转化率为37.5 % D、T0℃,从反应开始到平衡时:v(X)=0.083 mol·L-1·min-18. 在固定容积的密闭容器中,A和B发生下列反应:A(S)+2B(g) 2C(g) △H>0,在一定条件下达到平衡,若升高温度则达平衡后混合气体的( )A、气体的分子数减少 B、A的物质的量浓度减小 C、气体的密度减小 D、气体的平均相对分子质量增大9. 用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉; ②加入少量NaNO3固体; ③加入少量CuSO4固体;
④加入少量CH3COONa固体; ⑤加热; ⑥将稀硫酸换成98%硫酸。
其中可以加快氢气的生成速率的措施是( )
A、①③④ B、①③⑤ C、②④⑤ D、②⑤⑥10. T℃时,对于可逆反应:A(g)+B(g) 2C(g)+D(g)△H>0,下列各图中正确的是( )A、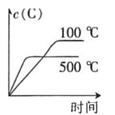 B、
B、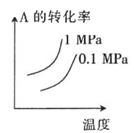 C、
C、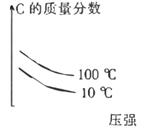 D、
D、
二、综合题
-
11. 燃煤产生的烟气中含有较多的CO2、CO、SO2等影响环境的气体。如何综合利用这些气体一直是科研单位研究的热点。
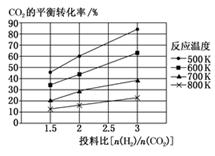 (1)、已知:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH1
(1)、已知:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH1CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH3
用ΔH2、ΔH3表示ΔH1 , ΔH1=
(2)、针对CO2与H2反应转化为二甲醚(g)和H2O(g),研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:①ΔH1(填“>”或“<”)0。
②若其他条件不变,仅仅增大压强,则逆反应速率会(填“增大”“减小”或“不变”,下同),平衡常数K会。
(3)、研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为2CO(g)+SO2(g)=2CO2(g)+S(l) ΔH=-270 kJ·mol-1。
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是
②若在2 L恒容密闭容器中,将3 mol CO、1 mol SO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=。
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是(填字母)。
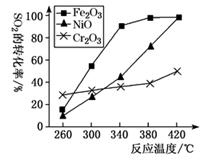
A.CO B.SO2 C.N2 D.H2S E.CO2
12. 已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其化学平衡常数为K2 , 在温度973 K和1 173 K的情况下,K1、K2的值分别如下:温度
K1
K2
973 K
1.47
2.38
1 173 K
2.15
1.67
请填空:
(1)、反应①的K1表达式是。(2)、现有反应③:CO2(g)+H2(g) CO(g)+H2O(g),该反应的平衡常数K3 , 根据反应①与②可推导出K1、K2与K3之间的关系式为 , 据此关系式及上表数据,能推断出反应③是(填“吸热”或“放热”)反应。(3)、能判断反应③一定处于化学平衡状态的依据是 (填写字母序号)。A、压强不随时间改变 B、气体密度不随时间改变 C、H2的体积分数不随时间改变 D、单位时间内生成H2和H2O(g)的物质的量相等(4)、图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
①图甲中t2时刻发生改变的条件是。
②图乙中t2时刻发生改变的条件是。
(5)、一定条件下处于化学平衡状态的反应③当使CO2和CO的浓度同时增大为原来的两倍时,该反应的化学平衡向移动(填“不”、“逆反应方向”或“正反应方向”)13. 在1L恒容密闭容器中,发生反应2NO(g)+O2(g) 2NO2(g)。(1)、某温度时,按物质的量比2:1充入NO和O2开始反应,N(NO)随时间变化如表:
以O2浓度变化表示的反应速率,0~4s内的(填“小于”、“大于”或“等于”)1~5s内的。
(2)、该反应的平衡常数表达式为K= , 能说明该反应已达到平衡状态的是。A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.v逆(NO)=2v正(O2) D.气体密度保持不变
(3)、已知:K(300℃)>K(400℃)。下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是。A、升高温度 B、充入Ar使压强增大 C、充入O2使压强增大 D、选择高效催化剂14. 甲醇是一种可再生能源,具有广泛的应用前景。工业上采用下列两种反应合成甲醇:反应I:CO(g)+2H2(g) CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g) CH3OH(g) + H2O(g) ΔH2
(1)、下表所列数据是反应I在不同温度下的化学平衡常数(K)。温度
250℃
300℃
350℃
K
2.04
0.25
0.012
①由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,5 min后达到平衡,测得c(CO)=0.2 mol/L,则用H2表示的5min内该反应的反应速率v(H2)=mol·L-1·min-1 , 该温度下此反应的平衡常数为 , 此时的温度为(从上表中选择)。
(2)、一定条件下,将1 mol CO与 3 mol H2的混合气体在催化剂作用下能自发反应生成甲醇。若容器容积不变,下列措施可提高CO转化率的是________。A、升高温度 B、将CH3OH(g)从体系中分离 C、恒容条件下充入He D、再充入适量的 H2(3)、为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。实验编号
温度(℃)
n(CO)/n(H2)
压强(MPa)
①
a
1/2
0.2
②
200
b
5
③
350
1/2
0.2
A.则上表中剩余的实验条件数据:a=、b=。
B.根据反应I的特点,下图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强py=MPa。
 (4)、上述反应中需要用到H2做反应物,以甲烷为原料制取氢气是常用的制氢方法。已知:
(4)、上述反应中需要用到H2做反应物,以甲烷为原料制取氢气是常用的制氢方法。已知:①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1
②CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:。