2020高考化学常考知识点专练 06:电池
试卷日期:2020-06-01 考试类型:二轮复习
一、单选题
-
1. 化学与社会生活密切相关,下列说法正确的是( )A、军舰船底镶嵌锌块作正极,以防船体被腐蚀 B、汽车尾气中NO和CO可以缓慢反应生成N2和CO2 , 减小压强,反应速率减慢 C、金属冶炼过程是金属离子得电子变成金属单质的氧化过程 D、PM2.5颗粒 微粒直径约为2.5×10-6m)分散在空气中形成气溶胶2. 含氯苯的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是( )
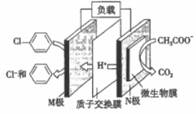 A、电子流向:N极→导线→M极→溶液→N极 B、M极的电极反应式为C6H5Cl+e-=C6H6+Cl- C、每生成1mol CO2 , 有3 mol e-发生转移 D、处理后的废水酸性增强3. SBP电解法能大幅度提高电解槽的生产能力,如图为SBP电解法制备MoO3的示意图,下列说法错误的是( )
A、电子流向:N极→导线→M极→溶液→N极 B、M极的电极反应式为C6H5Cl+e-=C6H6+Cl- C、每生成1mol CO2 , 有3 mol e-发生转移 D、处理后的废水酸性增强3. SBP电解法能大幅度提高电解槽的生产能力,如图为SBP电解法制备MoO3的示意图,下列说法错误的是( ) A、a极为电源的负极,发生氧化反应 B、电路中转移4mol电子,则石墨电极上产生标准状况下22.4LO2 C、钛基钛锰合金电极发生的电极反应为:3H2O+Mo4+-2e-=MoO3+6H+ D、电路中电子流向为:a极 石墨,钛基钛锰电极 b极4. 如图所示,甲池的总反应式为: ,下列关于该电池工作时的说法正确的是( )
A、a极为电源的负极,发生氧化反应 B、电路中转移4mol电子,则石墨电极上产生标准状况下22.4LO2 C、钛基钛锰合金电极发生的电极反应为:3H2O+Mo4+-2e-=MoO3+6H+ D、电路中电子流向为:a极 石墨,钛基钛锰电极 b极4. 如图所示,甲池的总反应式为: ,下列关于该电池工作时的说法正确的是( ) A、该装置工作时,Ag电极上有气体生成 B、甲池中负极反应为 C、甲池和乙池中的溶液的pH均减小 D、当甲池中消耗 时,乙池中理论上最多产生6.4g固体5. 下列措施中,不符合生产实际的是( )A、电解法精炼粗铜,用纯铜作阴扱 B、利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连 C、为保护地下管道中的金属铁,可将其与锌极相连 D、在镀件上电镀锌,用锌作阳极6. 根据Zn+Cu2+=Zn2++Cu的反应原理所设计原电池装置,正确的是 ( )A、
A、该装置工作时,Ag电极上有气体生成 B、甲池中负极反应为 C、甲池和乙池中的溶液的pH均减小 D、当甲池中消耗 时,乙池中理论上最多产生6.4g固体5. 下列措施中,不符合生产实际的是( )A、电解法精炼粗铜,用纯铜作阴扱 B、利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连 C、为保护地下管道中的金属铁,可将其与锌极相连 D、在镀件上电镀锌,用锌作阳极6. 根据Zn+Cu2+=Zn2++Cu的反应原理所设计原电池装置,正确的是 ( )A、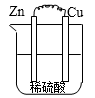 B、
B、 C、
C、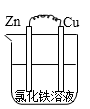 D、
D、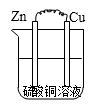 7. 下列有关电化学在生产、生活中的应用分析正确的是( )
7. 下列有关电化学在生产、生活中的应用分析正确的是( ) A、图1:铁钉发生析氢腐蚀 B、图2:可以在铁件上镀铜 C、图3:溶液中c(Cu2+)保持不变 D、图4:将输油管与电源负极相连可以防止腐蚀8. 我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是( )
A、图1:铁钉发生析氢腐蚀 B、图2:可以在铁件上镀铜 C、图3:溶液中c(Cu2+)保持不变 D、图4:将输油管与电源负极相连可以防止腐蚀8. 我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是( )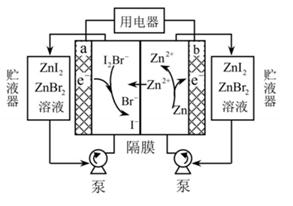 A、 放电时,a电极反应
A、 放电时,a电极反应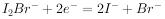 B、放电时,溶液中离子的数目增大
C、充电时,a电极接外电源负极
D、充电时,b电极每增重0.65g,溶液中有0.02mol I-被氧化
9. 电解KCl和NaNO3溶液可以得到KNO3溶液,电解装置如图所示,下列说法正确的是( )
B、放电时,溶液中离子的数目增大
C、充电时,a电极接外电源负极
D、充电时,b电极每增重0.65g,溶液中有0.02mol I-被氧化
9. 电解KCl和NaNO3溶液可以得到KNO3溶液,电解装置如图所示,下列说法正确的是( )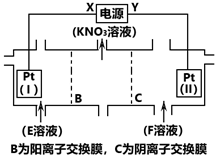 A、X为负极,F溶液为NaNO3溶液 B、电解一段时间,往Pt(I)附近滴入酚酞,溶液变红 C、电解的总反应为2H2O 2H2↑ + O2↑ D、理论上,当得到0.1molKNO3时,Pt(II)上生成标准状况下1.12L气体
A、X为负极,F溶液为NaNO3溶液 B、电解一段时间,往Pt(I)附近滴入酚酞,溶液变红 C、电解的总反应为2H2O 2H2↑ + O2↑ D、理论上,当得到0.1molKNO3时,Pt(II)上生成标准状况下1.12L气体二、综合题
-
10. 2019 年诺贝尔化学奖授予对锂电池及锂离子电池研究做出贡献的三位科学家。(1)、最早的可充电锂电池用金属锂作负极。锂在元素周期表中的位置是 , 属于活泼金属,使电池存在较大安全隐患。(2)、现在广泛使用的锂离子电池有多种类型。某可充电钴酸锂电池的工作原理如下图所示
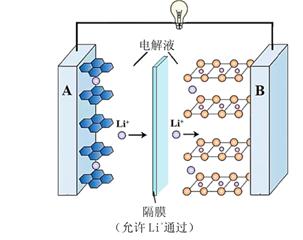
① 该电池放电时,其中一极的电极反应式是 LixC6 – xe- = 6C + xLi+,则该极应为上图中的(填“A”或“B”)
② 碳酸乙烯酯(EC)常用作电解液的溶剂,其结构为
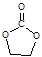 ,熔点 35℃,可燃,可由二氧化碳和有机物 X 在一定条件下合成。X 与乙醛互为同分异构体,核磁共振氢谱显示只有一组峰。写出合成 EC 的化学方程式:。
,熔点 35℃,可燃,可由二氧化碳和有机物 X 在一定条件下合成。X 与乙醛互为同分异构体,核磁共振氢谱显示只有一组峰。写出合成 EC 的化学方程式:。③ 从正极材料中回收钴和锂的流程如下:
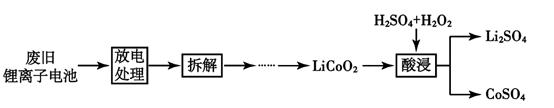
写出酸浸过程中发生反应的化学方程式。
拆解废旧电池前需进行放电处理,既可保证安全又有利于回收锂。有利于回收锂的原因是。
11. 新能源汽车所用蓄电池分为铅酸蓄电池、二次锂电池、空气电池等类型。请回答下列问题:(1)、2019年诺贝尔化学奖授予了为锂离子电池发展做出贡献的约翰·班宁斯特·古迪纳夫等三位科学家。如图所示为水溶液锂离子电池体系。放电时,电池的负极是(填a或b),溶液中Li+从迁移(填“a向b”或“b向a”)。 (2)、铅酸蓄电池是最常见的二次电池,电压稳定,安全可靠,价格低廉,应用广泛。电池总反应为Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
(2)、铅酸蓄电池是最常见的二次电池,电压稳定,安全可靠,价格低廉,应用广泛。电池总反应为Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)①放电时,正极的电极反应式是 , 电解质溶液中硫酸的浓度(填“增大”、“减小”或“不变”),当外电路通过0.5 mol e-时,理论上负极板的质量增加g。
②用该蓄电池作电源,进行粗铜(含Ag、Pt、Au等杂质)的电解精炼。如下图所示,电解液c选用溶液,A电极的材料是 , B电极反应式是。

③用该蓄电池作电源,A、B为石墨电极,c为氯化钠溶液,进行电解。如上图所示,则A电极产生的气体是 , B电极附近溶液的pH(填“增大”、“减小”或“不变”)。
12. 研究发现,NOx和SO2是雾霾的主要成分。(1)、I.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。已知:N2(g)+O2(g) 2NO(g) △H=+180 kJ·mol-1
2CO(g)+O2(g) 2CO2(g) △H=-564 kJ·mol-1
2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=。
(2)、T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示。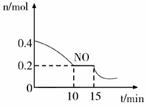
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=2MPa,则T℃时该反应的压力平衡常数Kp=;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.15 mol,平衡将 (填“向左”、“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
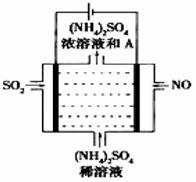
(3)、II.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为g。
 13. 观察下列装置,回答下列问题。
13. 观察下列装置,回答下列问题。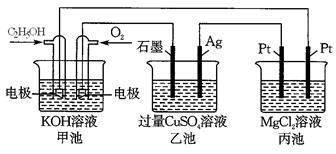 (1)、甲装置中通入乙醇的电极反应式为。(2)、用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极上的电极反应式是 , 在Ag电极附近观察到的现象是。(3)、电解一段时间,当甲池消耗了112 mLO2(标况下),此时乙装置中溶液的pH为(忽略电解前后体积变化)。若要将该溶液完全恢复到电解前的浓度和pH,需要补充的物质是 , 其物质的量为。(4)、丙装置中总反应的离子方程式为。14. 根据要求填空
(1)、甲装置中通入乙醇的电极反应式为。(2)、用上图装置电解200 mL 1mol/L CuSO4溶液,石墨电极上的电极反应式是 , 在Ag电极附近观察到的现象是。(3)、电解一段时间,当甲池消耗了112 mLO2(标况下),此时乙装置中溶液的pH为(忽略电解前后体积变化)。若要将该溶液完全恢复到电解前的浓度和pH,需要补充的物质是 , 其物质的量为。(4)、丙装置中总反应的离子方程式为。14. 根据要求填空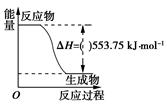 (1)、打火机、运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。已知一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化如右图,请写出表示丙烷燃烧热的热化学方程式:。(2)、CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
(1)、打火机、运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。已知一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化如右图,请写出表示丙烷燃烧热的热化学方程式:。(2)、CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下: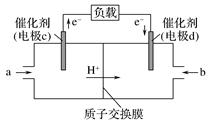
①电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是(填“正极”或“负极”),c电极的反应方程式为。
②用该燃料电池电解1L饱和食盐水(足量),当燃料电池消耗0.56L(标准状况下)氧气时,溶液pH=(不考虑溶液体积变化)。
(3)、有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是 , 该反应能设计成原电池的原因是。A是(填物质名称)。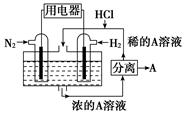 15. 按要求完成下列问题:
15. 按要求完成下列问题: (1)、A,B,C之间有如图的转化关系,若A为AlCl3 , 写出A和C反应的离子方程式:;(2)、检验Na2SO4和NaCl混合溶液中的Cl-的方法是:向少量混合液中加入足量a溶液,充分震荡后静置,然后取上层清液于试管中,再加入几滴b溶液,产生白色沉淀。试剂a、b分别是 、(3)、已知H2、CO的燃烧热分别是akJ∕mol、bkJ∕mol,1mol液态水变为气态水吸收ckJ热量,C(s) + H2O(g)= CO(g)+ H2(g)△H=dkJ∕mol,写出碳(C)燃烧的热化学方程式。
(1)、A,B,C之间有如图的转化关系,若A为AlCl3 , 写出A和C反应的离子方程式:;(2)、检验Na2SO4和NaCl混合溶液中的Cl-的方法是:向少量混合液中加入足量a溶液,充分震荡后静置,然后取上层清液于试管中,再加入几滴b溶液,产生白色沉淀。试剂a、b分别是 、(3)、已知H2、CO的燃烧热分别是akJ∕mol、bkJ∕mol,1mol液态水变为气态水吸收ckJ热量,C(s) + H2O(g)= CO(g)+ H2(g)△H=dkJ∕mol,写出碳(C)燃烧的热化学方程式。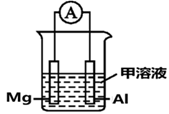 (4)、Mg、Al设计成如图所示原电池装置:若电解液为盐酸,正极的电极反应为。若电解液为氢氧化钠溶液,负极的电极反应为。(5)、写出用氢氧化钾做电解质溶液,甲醇(CH3OH)为燃料的负极的电极反应:。(6)、若铅蓄电池负极质量增加19.2g,则其正极质量增加 g。16. 甲醇是一种重要的有机化工原料。
(4)、Mg、Al设计成如图所示原电池装置:若电解液为盐酸,正极的电极反应为。若电解液为氢氧化钠溶液,负极的电极反应为。(5)、写出用氢氧化钾做电解质溶液,甲醇(CH3OH)为燃料的负极的电极反应:。(6)、若铅蓄电池负极质量增加19.2g,则其正极质量增加 g。16. 甲醇是一种重要的有机化工原料。 (1)、合成甲醇的反应为CO(g)+2H2(g) CH3OH(g) △H<0。相同条件下,向容积相同的a、b、c、d、e五个恒容密闭容器中均分别充入1 mol CO和2mol H2 , 在不同的温度下进行实验,测得反应进行到tmin时甲醇的体积分数如图甲所示。
(1)、合成甲醇的反应为CO(g)+2H2(g) CH3OH(g) △H<0。相同条件下,向容积相同的a、b、c、d、e五个恒容密闭容器中均分别充入1 mol CO和2mol H2 , 在不同的温度下进行实验,测得反应进行到tmin时甲醇的体积分数如图甲所示。①tmin时,a、b、c、d、e五个容器中,反应肯定达到平衡状态的是 (填字母)。
②tmin时,a、b、c、d、e五个容器中,反应速率最快的容器是(填字母)。
(2)、为实现污染物的利用,某研究小组设计了图乙所示装置,其反应原理为4CH3OH+6NO2+8OH=3N2+4CO32-+12H2O。
①电极A作 (填“正极”或“负极”)
②电极B的电极反应式为。
③若用该电池对铁制品表面镀铜,反应一段时间后,铁制品质量增加96g,则理论上消耗CH3OH的质量为g。
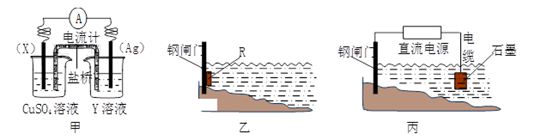
17.(1)、依据反应:2Ag+(aq)+Cu(s) Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。①电极X的材料是;Y溶液可以是;
②银电极上发生的电极反应式是。
③在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是(填离子符号)。
(2)、金属腐蚀一般可分为化学腐蚀和电化学腐蚀,可以采用电化学手段进行防腐。①炒菜的铁锅未及时清洗容易生锈。写出铁锅生锈过程的正极反应式。
②为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
③图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的极。
 (3)、蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2。
(3)、蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2。①若此蓄电池放电时,该电池某一电极发生还原反应的物质是(填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
②该电池放电时,正极附近溶液的pH(填增大、减小、不变)
③充电时该电池阳极的电极反应式。