2020高考化学常考知识点专练 05:周期表和周期律
试卷日期:2020-06-01 考试类型:二轮复习
一、单选题
-
1. 下列各组中的X和Y两种原子,化学性质一定相似的是( )A、X原子和Y原子最外层都只有一个电子 B、X原子的核外电子排布为1s2 , Y原子的核外电子排布为1s22s2 C、X原子2p能级上有三个电子,Y原子的3p能级上有三个电子 D、X原子核外M层上仅有两个电子,Y原子核外N层上仅有两个电子2. 短周期主族元素a、b、c、d、e的原子序数依次增大,A、B、C、D、E、F均是由上述元素组成的中学化学常见物质,其中A是四元化合物,C是能使湿润红色石蕊试纸变蓝的气体,D是淡黄色固体化合物,E是单质。各物质之间存在如下图转化关系(部分产物未标出)。下列说法不正确的是( )
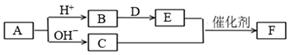 A、简单离子半径大小关系:c>d>e B、简单阴离子的还原性:a>c>d C、氢化物的沸点:c>d D、C和E反应生成F是工业制硝酸的重要反应之一3. 短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为23。下列说法不正确的是( )
A、简单离子半径大小关系:c>d>e B、简单阴离子的还原性:a>c>d C、氢化物的沸点:c>d D、C和E反应生成F是工业制硝酸的重要反应之一3. 短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为23。下列说法不正确的是( )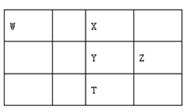 A、原子半径Y>Z,非金属性W<X B、X2能从T的气态氢化物中置换出T单质 C、W、Y、Z三种元素都能与X元素形成化合物WX2、YX2、ZX2 D、最高价氧化物对应水化物的酸性:W>Y>Z4. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法正确的是( )A、原子半径:Y>Z>X>W B、简单氢化物的热稳定性:W>X>Z C、Y、Z形成的化合物溶于水会促进水的电离 D、上述刺激性气体通入紫色石蕊溶液,溶液先变红后褪色5. 同周期的X、Y、Z三种元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是: HXO4>H2YO4>H3ZO4 , 则下列各判断中正确的是( )A、原子半径:X>Y>Z B、单质的非金属性:X<Y<Z C、原子序数:X>Y>Z D、气态氢化物稳定性:X<Y<Z6. 短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q。r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25 ℃,0.01 mol·L-1的v溶液中: =1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是( )
A、原子半径Y>Z,非金属性W<X B、X2能从T的气态氢化物中置换出T单质 C、W、Y、Z三种元素都能与X元素形成化合物WX2、YX2、ZX2 D、最高价氧化物对应水化物的酸性:W>Y>Z4. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法正确的是( )A、原子半径:Y>Z>X>W B、简单氢化物的热稳定性:W>X>Z C、Y、Z形成的化合物溶于水会促进水的电离 D、上述刺激性气体通入紫色石蕊溶液,溶液先变红后褪色5. 同周期的X、Y、Z三种元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是: HXO4>H2YO4>H3ZO4 , 则下列各判断中正确的是( )A、原子半径:X>Y>Z B、单质的非金属性:X<Y<Z C、原子序数:X>Y>Z D、气态氢化物稳定性:X<Y<Z6. 短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q。r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25 ℃,0.01 mol·L-1的v溶液中: =1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是( ) A、简单离子半径:W>Y>Z>X B、W和Y分別与X元素形成的简单化合物的沸点:Y>W C、Z2Y和ZX都只存在离子键 D、v能抑制水的电离,u能促进水的电离7. 2019年是元素周期表诞生150周年,目前周期表七个周期均已排满,共118种元素。短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。
A、简单离子半径:W>Y>Z>X B、W和Y分別与X元素形成的简单化合物的沸点:Y>W C、Z2Y和ZX都只存在离子键 D、v能抑制水的电离,u能促进水的电离7. 2019年是元素周期表诞生150周年,目前周期表七个周期均已排满,共118种元素。短周期元素W、X、Y、Z在周期表中的相对位置如图所示,且四种元素的原子最外层电子数之和为24。下列说法错误的是( )
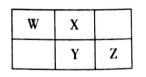 A、最高价氧化物对应水化物的酸性:Z>Y B、W的氢化物与Z的氢化物反应,产物的水溶液呈碱性 C、在元素周期表中,117号元素与Z元素位于同一主族 D、工业上常用YX2漂白纸浆、毛、丝等8. A,B,C,D四种短周期元素的原子序数依次增大,A 的一种核素在考古时常用来鉴定一些文物的年代,B的气态氢化物的水溶液呈碱性;C为金属元素且有两种常见含氧化合物(都含两种元素);若往D单质的水溶液中滴加少量紫色石蕊试液,可观察到先变红后褪色。下列说法中正确的是( )A、C的两种含氧化合物中阴阳离子个数比都为1:2 B、最高价氧化物对应的水化物的酸性B>D C、B的氢化物的沸点一定高于A的氢化物 D、原子半径D>A>B>C
A、最高价氧化物对应水化物的酸性:Z>Y B、W的氢化物与Z的氢化物反应,产物的水溶液呈碱性 C、在元素周期表中,117号元素与Z元素位于同一主族 D、工业上常用YX2漂白纸浆、毛、丝等8. A,B,C,D四种短周期元素的原子序数依次增大,A 的一种核素在考古时常用来鉴定一些文物的年代,B的气态氢化物的水溶液呈碱性;C为金属元素且有两种常见含氧化合物(都含两种元素);若往D单质的水溶液中滴加少量紫色石蕊试液,可观察到先变红后褪色。下列说法中正确的是( )A、C的两种含氧化合物中阴阳离子个数比都为1:2 B、最高价氧化物对应的水化物的酸性B>D C、B的氢化物的沸点一定高于A的氢化物 D、原子半径D>A>B>C二、综合题
-
9. X、Y、Z是阳离子,K是阴离子,M、N 是中性分子。它们都由短周期组成,且具有以下结构特征和性质:
①它们核外电子总数都相同;
②N 溶于M中,滴入酚酞,溶液变红;
③Y和K都由A、B两元素组成,Y 核内质子总数比K多两个;
④X和N 都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热情况下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量K溶液,有白色沉淀生成,再加入过量的K或Y的溶液,沉淀消失
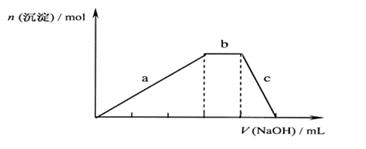
(1)、Y的化学式为 检验X 的离子的方法 (用离子方程式表示)(2)、试比较M和N 的稳定性:M N(3)、写出Z和N 的水溶液反应的离子方程式(4)、上述六种微粒中的两种阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入 0.1mol/L 的NaOH 溶液,出现了如右图中a、b、c三个阶段的图象,根据图象判断该盐的化学式为
(5)、将1.92g铜投入到一定量由A、B、C三种元素形成的一种常见化合物的溶液中,共收集到672mL气体(标准状况下),将盛有此气体的容器倒扣在水槽中,通入一定量的氧气,恰好使气体完全溶于水,则通入氧气在标准状况下的体积 mL
 10. 下表是元素周期表的一部分,请用化学符号回答有关问题:
10. 下表是元素周期表的一部分,请用化学符号回答有关问题:
周期
主族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
1
①
2
②
③
④
⑤
3
⑥
⑦
⑧
⑨
⑩
(1)、表中化学性质最不活泼的元素,其原子结构示意图为 。(2)、②、⑧、⑨、⑩四种元素的简单气态氢化物稳定性由强到弱的顺序是 , 最高价氧化物的水化物中酸性最强的是 。(3)、第三周期元素形成的简单离子中半径最小的微粒是 , 写出该元素的单质分别与⑥、⑩最高价氧化物的水化物反应的离子方程式、 。(4)、元素③的氢化物的电子式是;该氢化物与元素⑩的氢化物发生反应的化学方程式。(5)、用电子式分别写出元素⑩与元素②、⑥形成化合物过程 、。
11. 现有部分元素的性质与原子(或分子)结构如下表:元素编号
元素性质与原子(或分子)结构
T
最外层电子数是次外层电子数的3倍
X
常温下单质为双原子分子,分子中含有3对共用电子对
Y
M层比K层少1个电子
Z
第三周期元素的简单离子中半径最小
请根据表中信息回答下列问题
(1)、元素T在周期表中位于第周期第族(2)、元素T与X相比,原子半径较大的是 (用元素符号表示);(3)、T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,该化合物的电子式为该化合物与水反应方程式:
(4)、元素Y与元素Z相比,金属性较强的是(用元素符号表示);下列表述中能证明这一事实的是(填序号)。
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质剧烈
c.Y的化合价比Z低 d.Y最高价氧化物的水化物的碱性比Z强
(5)、元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:。12. 下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:族
周 期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
二
①
②
三
③
④
⑤
⑥
⑦
⑧
四
⑨
⑩
(1)、在这些元素中,化学性质最不活泼的原子的原子结构示意图为(2)、⑦的黄绿色单质的化学式为⑩的单质在常温下的存在状态为(3)、①的气态氢化物的水溶液显性⑥的元素符号为(4)、用电子式表示②与④形成化合物的过程(5)、这些元素中的最高价氧化物对应的水化物中,碱性最强的是呈两性的是(6)、写出⑤与盐酸反应的化学方程式:写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:13. X、Y、Z、W是原子序数依次增大的短周期主族元素。通常状况下,X与W元素均能形成-1价的气态氢化物,Y为同周期主族元素中原子半径最大的元素,X、Z和W的原子最外层电子数之和为20。回答下列问题:(1)、W在元素周期表中的位置是。(2)、X和Y元素简单离子的半径较大的是(填离子符号);Z和W元素气态氢化物的稳定性较弱的是(填化学式)。(3)、Y的氧化物中既含离子键又含共价键的是(用电子式表示)。(4)、Z的最高价氧化物对应水化物的浓溶液(过量)和氧化亚铜共热,反应的化学方程式为。14. 已知A、B、D、E、G、H、J都是周期表中前四周期的元素,它们的原子序数依次增大。其中A元素原子的最外层电子数是次外层电子数的2倍,B元素的最高正价与最低负价代数和为2,D是非金属性最强的元素,D、H同主族,E是同周期元素中离子半径最小的元素,G元素的最高价含氧酸为二元强酸,J是第Ⅷ族元素,是生活中最常用的金属元素。请回答:(1)、阴离子GAB-与CO2结构相似,GAB-的电子式为。(2)、D的氢化物水溶液中存在的氢键有种,画出其中一种。(用“…"表示氢键,用短线表示共价键)(3)、检验J3+的离子方程式为。(4)、H与E能形成化合物乙。在1.01×105Pa、T1℃时,气体摩尔体积为53.4L·mol-1 , 实验测得乙的气态密度为5.00g·L-1 , 则此时乙的化学式为。15. 元素周期表短周期中六种元素的原子序数与主要化合价的关系如图: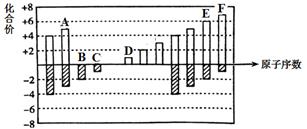 (1)、元素F在周期表中的位置是 。(2)、元素C、D、E原子半径由大到小的顺序是 (填元素符号)。(3)、A,B,C的单质与氢气反应的剧烈程度由强到弱的顺序(用单质的化学式表示)。(4)、应用元素周期律和元素周期表的知识,写出D和E所形成的化合物的化学式、(写2种)。(5)、根据氯、溴、碘单质间的置换反应,判断F的单质和E的最简单氢化物之间能否发生反应 (填“能”或“不能”), 若能则写出反应的化学方程式 。(6)、一定温度下,在体积恒定的密闭容器中发生反应:2AB(g)+B2(g) 2AB2(g)。可以作为达到平衡状态的标志是 ______。A、单位时间内生成nmolB2的同时生成2nmolAB B、2 ν正(B2)=ν逆(AB2) C、混合气体的颜色不再改变(AB2为有色气体) D、混合气体的密度不变
(1)、元素F在周期表中的位置是 。(2)、元素C、D、E原子半径由大到小的顺序是 (填元素符号)。(3)、A,B,C的单质与氢气反应的剧烈程度由强到弱的顺序(用单质的化学式表示)。(4)、应用元素周期律和元素周期表的知识,写出D和E所形成的化合物的化学式、(写2种)。(5)、根据氯、溴、碘单质间的置换反应,判断F的单质和E的最简单氢化物之间能否发生反应 (填“能”或“不能”), 若能则写出反应的化学方程式 。(6)、一定温度下,在体积恒定的密闭容器中发生反应:2AB(g)+B2(g) 2AB2(g)。可以作为达到平衡状态的标志是 ______。A、单位时间内生成nmolB2的同时生成2nmolAB B、2 ν正(B2)=ν逆(AB2) C、混合气体的颜色不再改变(AB2为有色气体) D、混合气体的密度不变