2020高考化学常考知识点专练 04:反应热
试卷日期:2020-06-01 考试类型:二轮复习
一、单选题
-
1. 高粱酿酒过程中的部分流程按顺序排列如下,其中能说明高粱转化过程中放出热量的是( )
 A、A B、B C、C D、D
A、A B、B C、C D、D -
2. 反应X+Y→Z(△H>0)分两步进行:①X+Y→W(△H<0),②W→Z(△H>0)。下列示意图中,能正确表示总反应过程中能量变化的是( )A、
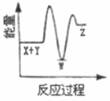 B、
B、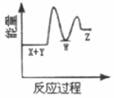 C、
C、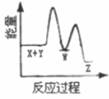 D、
D、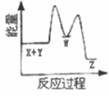
-
3. 以太阳能为热源分解Fe3O4 , 经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述不正确的是( )
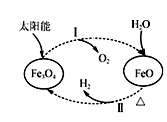
A、过程Ⅰ中的能量转化形式是太阳能→化学能 B、过程Ⅰ中每消耗116 g Fe3O4转移2 mol电子 C、过程Ⅱ的化学方程式为3FeO+H2O Fe3O4+H2↑ D、铁氧化合物循环制H2具有节约能源、产物易分离等优点 -
4. 根据下图所得判断正确的是( )

已知:H2O(g) = H2O(l) △H =﹣44 kJ/mol
A、图 1 反应为吸热反应 B、图 1 反应使用催化剂时,会改变其△H C、图 2 中若 H2O 的状态为液态,则能量变化曲线可能为① D、图 2 中反应为 CO2(g) + H2(g) = CO(g) + H2O(g) △H = + 41 kJ/mol -
5. 已知一定条件下断裂1 mol化学键生成气态原子需要吸收的能量如下:H—H 436 kJ;Cl—Cl 243 kJ;H—Cl 431 kJ。下列所得热化学方程式或结论正确的是( )A、氢分子中的化学键比氯气分子中的化学键更稳定 B、2HCl(g) = H2(g) + Cl2(g)的反应热ΔH<0 C、H2(g) + Cl2(g) = 2HCl(g) ΔH=−183 kJ D、相同条件下,H2(g)+ Cl2(g) =2HCl(g)反应在光照和点燃条件下的ΔH不相等
-
6. 如图是反应CO(g)+2H2(g)=CH3OH(g)进行过程中的能量变化曲线。下列相关说法正确的是( )
 A、该反应是吸热反应 B、使用催化剂后反应热减小 C、热化学方程式为CO(g)+2H2(g)=CH3OH(g) ΔH=-510 kJ·mol-1 D、曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化
A、该反应是吸热反应 B、使用催化剂后反应热减小 C、热化学方程式为CO(g)+2H2(g)=CH3OH(g) ΔH=-510 kJ·mol-1 D、曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化 -
7. 向Na2CO3溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是( )
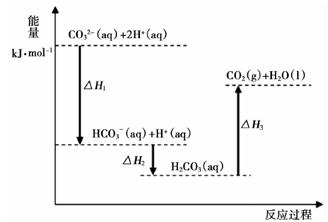 A、反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)为放热反应 B、CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) ΔH=(ΔH1+ΔH2+ΔH3) C、ΔH1>ΔH2 , ΔH2<ΔH3 D、H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则ΔH3变小
A、反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)为放热反应 B、CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) ΔH=(ΔH1+ΔH2+ΔH3) C、ΔH1>ΔH2 , ΔH2<ΔH3 D、H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则ΔH3变小 -
8. 已知充分燃烧a g乙炔(C2H2)气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则表示乙炔燃烧热的热化学方程式正确的是( )A、2C2H2(g)+5O2(g) =4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1 B、C2H2(g)+ O2(g) =2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1 C、C2H2(g)+ O2(g) =2CO2(g)+H2O(g) ΔH=+2b kJ·mol-1 D、2C2H2(g)+5O2(g) =4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-1
-
9. 已知化学反应①C(s)+ O2(g)=CO(g)△H=-Q1kJmol②2CO(g)+O2(g)=2CO2(g)△H=-Q2kJ/mol据此判断,下列说法正确的是(Q1、Q2均为正数,且其他条件相同)( )A、C的燃烧热为Q1kJ/mol B、2molCO(g)所具有的能量一定高于2molCO2(g)所具有的能量 C、一定质量的C燃烧,生成CO2(g)比生成CO(g)时放出的热量多 D、C燃烧生成CO2气体的热化学方程式为:C(s)+O2(g)=CO2(g)△H=-(Q1+Q2)kJ/mol
二、综合题
-
10. 已知:在25 oC 101KPa时
①1g氢气完全燃烧生成气态水放出120.9 KJ的热量
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
③Na2O2(s)+CO2(g)=Na2CO3(s)+ ΔH=-226 kJ/mol
在相同条件下根据以上信息回答下列问题:
(1)、请书写氢气完全燃烧生成气态水的热化学方程式。(2)、CO的燃烧热为ΔH=。(3)、请写出Na2O2(s)与CO(g)反应生成Na2CO3(s)的热化学方程式。(4)、请计算CO(g)与Na2O2(s)反应放出1018kJ热量时,转移电子的物质的量。 -
11.(1)、12g碳与适量水蒸气反应生成CO和H2 , 需吸收131.3KJ热量,此反应的热化学方程式为。(2)、已知以下的热化学反应方程式:
①2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=。
(3)、已知H2(g)+Br2(l)=2HBr(g) △H=-102kJ/mol,其他的相关数据如下表:H2(g)
Br2(l)
HBr(g)
1mol分子中的化学键断裂时需要吸收的能量/kJ
436
a
369
则表中a为。
-
12. 燃煤产生的烟气中含有较多的CO2、CO、SO2等影响环境的气体。如何综合利用这些气体一直是科研单位研究的热点。
 (1)、已知:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH1
(1)、已知:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH1CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH3
用ΔH2、ΔH3表示ΔH1 , ΔH1=
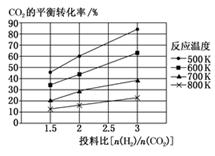
(2)、针对CO2与H2反应转化为二甲醚(g)和H2O(g),研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:①ΔH1(填“>”或“<”)0。
②若其他条件不变,仅仅增大压强,则逆反应速率会(填“增大”“减小”或“不变”,下同),平衡常数K会。
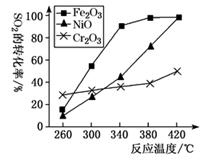
(3)、研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为2CO(g)+SO2(g)=2CO2(g)+S(l) ΔH=-270 kJ·mol-1。
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是
②若在2 L恒容密闭容器中,将3 mol CO、1 mol SO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=。
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是(填字母)。
A.CO B.SO2 C.N2 D.H2S E.CO2
-
13. “天宫一号”于2011年9月在酒泉卫星发射中心发射,标志着我国的航空航天技术迈进了一大步火箭的第一、二级发动机中,所用的燃料为偏二甲胼和四氧化二氮,偏二甲肼可用胼来制备。(1)、用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水
已知:N2(g)+2O2(g)=N2O4(g)△H=10.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ·mol-1
写出气态肼和N2O4反应的热化学方程式为 。
(2)、已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮,试推断由二氧化氮制取四氧化二氮的反应条件(或措施)。(3)、25℃,101kPa时,14gCO在足量的O2中充分燃烧,放出141.3kJ的热,则CO的燃烧热为 , 其燃烧的热化学方程式是。(4)、0.50L2.00mol/LH2SO4溶液与2.00L1.00mol/LKOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为 , 表示其中和热的热化学方程式为 。(5)、已知拆开1 molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式是。 -
14. 氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:(1)、肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知3.2g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量61.25kJ,则该反应的热化学方程式为。(2)、尾气中的NO2可以用烧碱溶液吸收的方法来处理,其中能生成NaNO2等物质,该反应的离子方程式为。(3)、在773K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3 , 气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如下图所示。
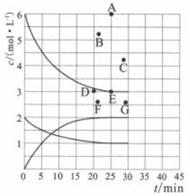
①下列能说明反应达到平衡状态的是(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4.00 mol N2和12.00 mol H2 , 则反应刚达到平衡时,表示c(H2)~t的曲线上相应的点为(选填字母)。
(4)、在373K时,向体积为2L的恒容真空容器中充入0.40 mol NO2 , 发生如下反应:2NO2 N2O4(g) △H=-56.9 kJ·mol-1
测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:

①计算0~20min时,v(N2O4)=。
②已知该反应v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时, ;改变温度至T1时,k1=k2 , 则T1373K(填“>”“<”或“=”)。
-
15. 氮循环是指氮在自然界中的循环转化过程,含有较多蓝、绿藻类的酸性水体中存在如下图所示的氮循环。

请回答下列相关问题:
(1)、氮气在藻类作用下转化成含氮有机物的过程叫做 。(2)、NO3-在反硝化细菌作用下转化成氮气的总反应是:2NO3-(aq)+10e-+12H+(aq)=N2(g)+6H2O(I)△H
反硝化过程实际分多步进行(全过程电子均来自作电子供体的同种有机物),其中的三步反应为:
NO3-(aq)+2e-+3H+(aq)==HNO2(aq)+H2O(I) △H1
HNO2(aq)+e-+H+(aq)=NO(g)+H2O(I) △H2
N2O(g)+2e-+2H+(aq)=N2(g)+H2O(I) △H3
则另一步反应2NO(g)+2e-+2H+(aq)=N2O(g)+H2O(Ⅰ)的反应热△H4=(用含△H、△H1、△H2、△H3的代数式表示)。水体中发生反硝化作用可减弱硝酸积累对水中生物的危害,但土壤中过多发生反硝化作用对农业生产不利,原因是 。
(3)、NH4+硝化过程的化学方程式是2NH4++3O2 2HNO2+2H2O+2H+ , 恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是(填标号)。A.溶液的pH不再改变
B.NH4+的消耗速率和H+的生成速率相等
C.溶液中氮原子的总物质的量保持不变
D.断开3molO=O键的同时消耗2molH2O
实验测得在其它条件一定时,NH4+硝化反应的速率随温度变化曲线如下图所示,温度高于35℃时,反应速率迅速下降的原因可能是。
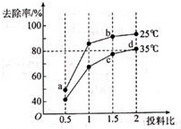
 (4)、亚硝酸盐含量过高对人和动植物都会造成直接或间接的危害,处理亚硝酸盐的方法之一是用次氯酸钠将亚硝酸盐氧化为硝酸盐,反应方程式是ClO-+NO2-=NO3-+Cl-。在25℃和35℃下,分别向NO2-的初始浓度为5×10-3mol/L的溶液中按不同的投料比[ ]加入次氯酸钠固体,平衡时NO2-的去除率和温度投料比的关系如下图所示,a、b、c、d四点ClO-的转化率由小到大的顺序是 ,35℃时,该反应的平衡常数K= (保留三位有效数字)。
(4)、亚硝酸盐含量过高对人和动植物都会造成直接或间接的危害,处理亚硝酸盐的方法之一是用次氯酸钠将亚硝酸盐氧化为硝酸盐,反应方程式是ClO-+NO2-=NO3-+Cl-。在25℃和35℃下,分别向NO2-的初始浓度为5×10-3mol/L的溶液中按不同的投料比[ ]加入次氯酸钠固体,平衡时NO2-的去除率和温度投料比的关系如下图所示,a、b、c、d四点ClO-的转化率由小到大的顺序是 ,35℃时,该反应的平衡常数K= (保留三位有效数字)。