2014年广西崇左市中考化学试卷
试卷日期:2017-05-10 考试类型:中考真卷
一、单项选择题
-
1. 下列变化中,属于化学变化的是( )A、
 铁水铸成锅
B、
铁水铸成锅
B、 折纸鹤
C、
折纸鹤
C、 烧制陶瓷
D、
烧制陶瓷
D、 编制中国结
2. 发明联合制碱法,为纯碱和氮肥工业技术的发展作出了杰出贡献的科学家是( )A、张青莲 B、侯德榜 C、门捷列夫 D、拉瓦锡3. 糖块放到水里会逐渐“消失”,而水却有了甜味.这一现象说明( )A、分子的体积很小 B、分子是由原子构成的 C、分子在不断运动 D、分子本身发生了变化4. 下列实验操作正确的是( )A、
编制中国结
2. 发明联合制碱法,为纯碱和氮肥工业技术的发展作出了杰出贡献的科学家是( )A、张青莲 B、侯德榜 C、门捷列夫 D、拉瓦锡3. 糖块放到水里会逐渐“消失”,而水却有了甜味.这一现象说明( )A、分子的体积很小 B、分子是由原子构成的 C、分子在不断运动 D、分子本身发生了变化4. 下列实验操作正确的是( )A、 点燃酒精灯
B、
点燃酒精灯
B、 往试管中加入锌粒
C、
往试管中加入锌粒
C、 称量氢氧化钠
D、
称量氢氧化钠
D、 收集氧气
5. 水是一种重要的自然资源.下列有关水的认识正确的是( )A、水是人体必需的营养素之一 B、长期饮用纯净水有利身体健康 C、生活中可以通过过滤把硬水转变为软水 D、水通电分解生成氢气和氧气的体积比为2:1,说明水是由2个氢元素和1个氧元素组成的6. 利用能源、节约能源是我们大家共同关注的社会问题.下列属于节能图标的是( )A、
收集氧气
5. 水是一种重要的自然资源.下列有关水的认识正确的是( )A、水是人体必需的营养素之一 B、长期饮用纯净水有利身体健康 C、生活中可以通过过滤把硬水转变为软水 D、水通电分解生成氢气和氧气的体积比为2:1,说明水是由2个氢元素和1个氧元素组成的6. 利用能源、节约能源是我们大家共同关注的社会问题.下列属于节能图标的是( )A、 B、
B、 C、
C、 D、
D、 7. 下列实验现象描述不正确的是( )A、纯羊毛制品点燃后有烧焦羽毛气味产生 B、黄铜片与铜片互相刻画,黄铜片可以在铜片上画出痕迹 C、硫在空气中燃烧产生明亮的蓝紫色火焰,生成有刺激性气味的气体 D、将少量熟石灰粉末与硝酸铵固体混合、研磨,能嗅到强烈的刺激性气味8. 2014年世界环境日中国的主题是“向污染宣战”.下列措施可以减少污染的是( )A、工广烟囱架高 B、提倡使用公共交通工具或步行 C、随意丢弃废旧电池 D、为了提高农作物产量,过量使用农药化肥9. 如图是元素周期表中某元素信息示意图,由图所获取的信息正确的是( )
7. 下列实验现象描述不正确的是( )A、纯羊毛制品点燃后有烧焦羽毛气味产生 B、黄铜片与铜片互相刻画,黄铜片可以在铜片上画出痕迹 C、硫在空气中燃烧产生明亮的蓝紫色火焰,生成有刺激性气味的气体 D、将少量熟石灰粉末与硝酸铵固体混合、研磨,能嗅到强烈的刺激性气味8. 2014年世界环境日中国的主题是“向污染宣战”.下列措施可以减少污染的是( )A、工广烟囱架高 B、提倡使用公共交通工具或步行 C、随意丢弃废旧电池 D、为了提高农作物产量,过量使用农药化肥9. 如图是元素周期表中某元素信息示意图,由图所获取的信息正确的是( )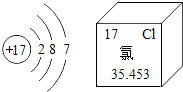 A、该元素为金属元素 B、该元素的相对原子质量为35.453g C、该元素位于元素周期表的第三周期 D、该元素在化学反应中容易失去电子10. 我国曾多次发生将工业用盐如亚硝酸钠(NaNO2)误作食盐用于烹调而引起的中毒事件.(NaNO2)中氮元素的化合价是( )A、+2 B、+3 C、+4 D、+511. 在化学反应A+B2=AB2中,A与B2反应的质量关系如图所示,现将8gA和5gB2充分反应,则生成AB2的质量是( )
A、该元素为金属元素 B、该元素的相对原子质量为35.453g C、该元素位于元素周期表的第三周期 D、该元素在化学反应中容易失去电子10. 我国曾多次发生将工业用盐如亚硝酸钠(NaNO2)误作食盐用于烹调而引起的中毒事件.(NaNO2)中氮元素的化合价是( )A、+2 B、+3 C、+4 D、+511. 在化学反应A+B2=AB2中,A与B2反应的质量关系如图所示,现将8gA和5gB2充分反应,则生成AB2的质量是( ) A、10g B、13g C、16g D、18g12. 除去下列物质中的少量杂质,所选用的试剂及反应类型均正确的是
A、10g B、13g C、16g D、18g12. 除去下列物质中的少量杂质,所选用的试剂及反应类型均正确的是选项
物质(括号内为杂质)
试剂
反应类型
A
CO2(CO)
足量 CuO
化合反应
B
CuO(Cu)
足量 O2
置换反应
C
H2O(H2O2)
足量 MnO2
分解反应
D
Ca(OH)2(CaO)
适量稀盐酸
复分解反应
A、A B、B C、C D、D13. 在常温下,将下列物质各5g分别放入50g水中,充分搅拌,现象最相似的是( )A、CaO,NaOH B、NaCl,FeCl3 C、CaCO3 , Na2CO3 D、KNO3 , NH4NO314. 已知元素化合价升高,该物质具有还原性.现有反应:2Na+H2O=2NaOH+H2↑,该反应中具有还原性是( )A、Na B、H2O C、NaOH D、H215. 下列各图中 和
和  分别表示两种不同元素的原子.有关说法正确的是( ) A、
分别表示两种不同元素的原子.有关说法正确的是( ) A、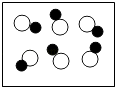 图表示混合物
B、
图表示混合物
B、 图表示单质
C、
图表示单质
C、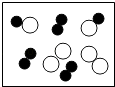 图表示化合物
D、
图表示化合物
D、 图可能是氧化物
16. 下列物质俗称、学名、化学式一致的是( )A、水银 汞 Hg B、纯碱 氢氧化钠 NaOH C、生石灰 氧化钙 CaO2 D、小苏打 碳酸钠 NaHCO317. 日前,一种集观赏与空气净化于一体的工艺品炭雕(如图所示,主要成分是木炭)成为了家装的新宠.炭雕之所以能用于空气净化是源于它具有( )
图可能是氧化物
16. 下列物质俗称、学名、化学式一致的是( )A、水银 汞 Hg B、纯碱 氢氧化钠 NaOH C、生石灰 氧化钙 CaO2 D、小苏打 碳酸钠 NaHCO317. 日前,一种集观赏与空气净化于一体的工艺品炭雕(如图所示,主要成分是木炭)成为了家装的新宠.炭雕之所以能用于空气净化是源于它具有( ) A、稳定性 B、吸附性 C、可燃性 D、还原性18. 分离下列各组混合物,其操作包括溶解、过滤、结晶三个步骤的是( )A、氯化钾和二氧化锰 B、氯化钠和硝酸钾 C、氧化铁和氧化铝 D、硝酸铜和氢氧化钠19. 青少年摄入锌不足会引起食欲不振,生长迟缓,发育不良,缺锌者可在医生指导下服用葡萄糖酸锌口服液来补锌.已知葡萄糖酸锌的化学式为C12H22O14Zn.下列说法正确的是( )A、葡萄糖酸锌口服液是纯净物 B、葡萄糖酸锌中碳、氢元素质量比为6:11 C、葡萄糖酸锌中锌元素的质量分数为14.3% D、葡萄糖酸锌是由12个碳原子、22个氢原子、14个氧原子和1个锌原子构成的20. 下列各组溶液混合,能发生化学反应,并且一定能得到无色透明溶液的是( )A、CuSO4 , NaOH,NaCl B、NaCl,KCl,KNO3 C、NaOH,NaCl,HCl D、MgCl2 , AgNO3 , NaOH
A、稳定性 B、吸附性 C、可燃性 D、还原性18. 分离下列各组混合物,其操作包括溶解、过滤、结晶三个步骤的是( )A、氯化钾和二氧化锰 B、氯化钠和硝酸钾 C、氧化铁和氧化铝 D、硝酸铜和氢氧化钠19. 青少年摄入锌不足会引起食欲不振,生长迟缓,发育不良,缺锌者可在医生指导下服用葡萄糖酸锌口服液来补锌.已知葡萄糖酸锌的化学式为C12H22O14Zn.下列说法正确的是( )A、葡萄糖酸锌口服液是纯净物 B、葡萄糖酸锌中碳、氢元素质量比为6:11 C、葡萄糖酸锌中锌元素的质量分数为14.3% D、葡萄糖酸锌是由12个碳原子、22个氢原子、14个氧原子和1个锌原子构成的20. 下列各组溶液混合,能发生化学反应,并且一定能得到无色透明溶液的是( )A、CuSO4 , NaOH,NaCl B、NaCl,KCl,KNO3 C、NaOH,NaCl,HCl D、MgCl2 , AgNO3 , NaOH二、填空题
-
21. 化学用语是学习和研究化学的重要工具,请按要求完成下列各题:(1)、请用元素符号回答:
①幼儿及青少年缺会患佝偻病和发育不良;
②甘蔗是我市主要的经济作物之一,为了增强甘蔗的抗倒伏能力可以适当施用肥.
(2)、请用离子符号回答:①食盐的主要成分是氯化钠,它是由和氯离子构成的;
②碱具有一些相似的化学性质,是因为碱溶液中都含有 .
(3)、请用化学式回答:①农业上用来改良酸性土壤的是;
②碘酒是家庭常备药,碘酒中的溶剂是 .
(4)、请用化学方程式回答:①正常雨水呈弱酸性,原因是;
②生活中的铝制品抗腐蚀性能好,原因是 .
22. 2014年4月11日某市自来水出现了严重的苯含量超标事故.苯的化学式为C6H6 , 它是一种液体,无色透明,有香味,难溶于水,易溶于有机溶剂,本身也可作为有机溶剂.在常温下,苯还是一种易燃的化合物,有高的毒性,对神经系统、造血系统有损害,也是一种致癌物,长期接触苯可引起白血病等病症.根据上述内容,回答下列问题:(1)、苯属于 物(填“有机”或“无机”);其中描述苯的物理性质的是(只填一点,下同);描述苯的化学性质的是;描述苯的用途的是 .(2)、写出苯在空气中燃烧的化学方程式: .23. 如图是A、B、C三种物质的溶解度曲线图,请看图回答问题: (1)、20℃时,A、B、C三种物质的溶解度由小到大的顺序是;(2)、50℃时,将30gA物质放入50g水中,充分溶解,所得溶液为(填“饱和”或“不饱和”)溶液,此时溶液中溶质质量分数为;(精确到0.1%)(3)、使一定量接近饱和的C物质溶液变成饱和溶液,采用的一种方法是 .24. 向CuSO4和ZnSO4的混合溶液中加入过量的镁粉,充分反应后过滤,所得固体一定有 , 所得滤液的质量与原混合溶液质量相比(填“增大”、“减少”或“不变”),请写出有关的化学反应方程式:(任写一个).25. 氢气被认为是最理想的清洁燃料,它与广泛采用的化石燃料相比有什么优点?(答两点即可)
(1)、20℃时,A、B、C三种物质的溶解度由小到大的顺序是;(2)、50℃时,将30gA物质放入50g水中,充分溶解,所得溶液为(填“饱和”或“不饱和”)溶液,此时溶液中溶质质量分数为;(精确到0.1%)(3)、使一定量接近饱和的C物质溶液变成饱和溶液,采用的一种方法是 .24. 向CuSO4和ZnSO4的混合溶液中加入过量的镁粉,充分反应后过滤,所得固体一定有 , 所得滤液的质量与原混合溶液质量相比(填“增大”、“减少”或“不变”),请写出有关的化学反应方程式:(任写一个).25. 氢气被认为是最理想的清洁燃料,它与广泛采用的化石燃料相比有什么优点?(答两点即可)a.;b. .
三、简答题
-
26. 化学是一把双刃剑,有利也弊.您瞧!如图是某“暖宝宝”外包装的图片.该“暖宝宝”中发热剂的主要成分有铁粉、活性炭、氯化钠、水等,其发热原理就是利用铁生锈时会放热.
 (1)、发热剂需接触到空气才会发热,原因是铁要与、等物质共同作用才会生锈;(2)、推测发热剂成分中氯化钠的作用是 .(3)、厨房中的切菜刀也是铁制品,写出防止其生锈的﹣种方法 .27. 构建知识网络,可以帮助我们理解知识的内在联系.如图是某无色溶液X与不同类物质间反应的知识网络.请回答:
(1)、发热剂需接触到空气才会发热,原因是铁要与、等物质共同作用才会生锈;(2)、推测发热剂成分中氯化钠的作用是 .(3)、厨房中的切菜刀也是铁制品,写出防止其生锈的﹣种方法 .27. 构建知识网络,可以帮助我们理解知识的内在联系.如图是某无色溶液X与不同类物质间反应的知识网络.请回答: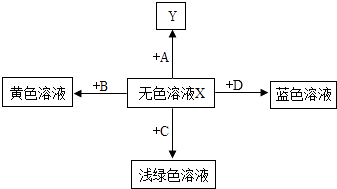 (1)、若X是稀盐酸,Y是红色溶液,A是一种指示剂,则试剂A的名称是;(2)、若X是稀盐酸,Y是白色沉淀,则A、B、C、D四种物质依次为:A是 , B是 , C是 , D是 .(3)、若X是稀硫酸,D是碱,则X与D反应的化学方程式为 , 其反应的基本类型为 .
(1)、若X是稀盐酸,Y是红色溶液,A是一种指示剂,则试剂A的名称是;(2)、若X是稀盐酸,Y是白色沉淀,则A、B、C、D四种物质依次为:A是 , B是 , C是 , D是 .(3)、若X是稀硫酸,D是碱,则X与D反应的化学方程式为 , 其反应的基本类型为 .四、实验与探究题
-
28. 小明是一名“小马虎”,他在用高锰酸钾制取氧气,并进行氧气性质实验时遇到了下列问题,请你帮他解决.
 (1)、水槽中的水变成了红色,原因是 , 你的改进措施是 .(2)、做细铁丝在氧气中燃烧的实验时,没有看到“剧烈燃烧,火星四射”的现象,你认为实验失败的可能原因:(至少写两条)
(1)、水槽中的水变成了红色,原因是 , 你的改进措施是 .(2)、做细铁丝在氧气中燃烧的实验时,没有看到“剧烈燃烧,火星四射”的现象,你认为实验失败的可能原因:(至少写两条)① , ② .
(3)、写出实验室用高锰酸钾制取氧气的化学方程式: .29. 小强在一次查阅资料时得知:二氧化碳与氢氧化钠反应,若二氧化碳过量,生成的碳酸钠会继续与二氧化碳反应生成碳酸氢钠,反应原理为:Na2CO3+CO2+H2O=2NaHCO3 . 出于好奇,他和同学一起向一定量的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后,低温蒸发结晶,得到了白色固体.【提出问题】白色固体是什么?
(1)、【作出猜想】猜想Ⅰ:只有Na2CO3;
猜想Ⅱ:可能是Na2CO3和NaOH的混合物;
猜想Ⅲ:
【査阅资料】
①碳酸氢钠不稳定受热易分解2NaHCO3 Na2CO3+CO2↑+H2O
②Na2CO3与NaOH的热稳定性较好
③CaCl2和NaCl的水溶液呈中性
【设计实验】
取一定量的白色固体,加热,若固体质量不变,猜想错误;若固体质量减少,则二氧化碳与氢氧化钠反应后,过量.
(2)、【交流讨论】小方认为,要想知道白色固体中是否有氢氧化钠,可将白色固体配成溶液后,直接用pH试纸测试即可作出判断,你认为是否可行?;理由是 .
(3)、【继续探究】白色固体中是否有氢氧化钠?实验操作
实验现象
目的/结论
①取白色固体适量配制成溶液.往所得溶液中滴加过量的 , 充分反应后,过滤.
有白色沉淀生成
除去白色固体中的
②取滤液,往滤液中滴入几滴
白色固体中没有氢氧化钠
【交流与反思】
由于氢氧化钠能与二氧化碳反应,所以实验室保存氢氧化钠一定要注意 .
五、计算题
-
30. 造纸厂生产会产生含氢氧化钠的废水,需经处理呈中性后排放.为测定此废水中氢氧化钠的质量分数,小华取80g废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,如图所示.
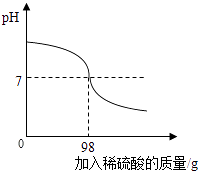 (1)、恰好完全反应时,所加稀硫酸的质量为g.(2)、计算废水中氢氧化钠的质量分数.
(1)、恰好完全反应时,所加稀硫酸的质量为g.(2)、计算废水中氢氧化钠的质量分数.