2016-2017学年山东省烟台市高一下学期期中化学试卷
试卷日期:2017-07-20 考试类型:期中考试
一、选择题:
-
1. 下列说法正确的是( )A、化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 B、所有化学变化的能量都可以通过原电池转化为电能 C、所有化学变化一定遵循质量守恒和能量守恒 D、化学变化一定会引起物质种类的变化,所以体系内物质种类变化一定发生了化学变化2. 钾和钠的性质相似,下列说法中能较好地解释这个事实的是( )A、都是金属元素 B、最外层电子数相同 C、原子半径相差不大 D、最高化合价相同3. 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
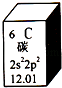 A、该元素的原子序数为6 B、该元素所有原子的质子数均为6 C、该元素的相对原子质量为12.01 D、该元素没有同位素,所有原子的中子数均为64. 合成氨工业为人类解决粮食问题做出了巨大贡献.一定条件下,在密闭容器中进行合成氨反应:N2(g)+3H2(g)⇌2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是( )A、N2、H2完全转化为NH3 B、N2、H2、NH3在容器中共存 C、反应已达到化学平衡状态 D、N2、H2、NH3的浓度不再改变5. 下列有关原电池的说法中不正确的是( )A、在内电路中,电子由正极流向负极 B、原电池的正、负极材料不一定都参与反应 C、原电池工作时,正极上发生还原反应 D、原电池工作时,可能会伴随着热能变化6. 某反应X+3Y⇌2E+2F,在甲、乙、丙、丁四种不同条件下,分别测得反应速率为甲:v(X)=0.3mol•L﹣1•min﹣1 , 乙:v(Y)=0.3mol•L﹣1•min﹣1 , 丙:v(E)=0.4mol•L﹣1•min﹣1 , 丁:v(F)=0.02mol•L﹣1•min﹣1 , 则反应速率最快的是( )A、甲 B、乙 C、丙 D、丁7. 下列有关化学用语表示正确的是( )A、次氯酸的结构式:H﹣Cl﹣O B、1H、2H、3H是同一种核素 C、S2﹣的结构示意图:
A、该元素的原子序数为6 B、该元素所有原子的质子数均为6 C、该元素的相对原子质量为12.01 D、该元素没有同位素,所有原子的中子数均为64. 合成氨工业为人类解决粮食问题做出了巨大贡献.一定条件下,在密闭容器中进行合成氨反应:N2(g)+3H2(g)⇌2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是( )A、N2、H2完全转化为NH3 B、N2、H2、NH3在容器中共存 C、反应已达到化学平衡状态 D、N2、H2、NH3的浓度不再改变5. 下列有关原电池的说法中不正确的是( )A、在内电路中,电子由正极流向负极 B、原电池的正、负极材料不一定都参与反应 C、原电池工作时,正极上发生还原反应 D、原电池工作时,可能会伴随着热能变化6. 某反应X+3Y⇌2E+2F,在甲、乙、丙、丁四种不同条件下,分别测得反应速率为甲:v(X)=0.3mol•L﹣1•min﹣1 , 乙:v(Y)=0.3mol•L﹣1•min﹣1 , 丙:v(E)=0.4mol•L﹣1•min﹣1 , 丁:v(F)=0.02mol•L﹣1•min﹣1 , 则反应速率最快的是( )A、甲 B、乙 C、丙 D、丁7. 下列有关化学用语表示正确的是( )A、次氯酸的结构式:H﹣Cl﹣O B、1H、2H、3H是同一种核素 C、S2﹣的结构示意图: D、四氯化碳的电子式:
D、四氯化碳的电子式: 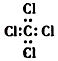 8. 下列叙述中,正确的是( )A、某物质中只含有一种元素,该物质一定是纯净物 B、含有共价键的化合物一定是共价化合物 C、含有离子键的化合物一定是离子化合物 D、离子化合物只含离子键9. 已知X+Y═M+N反应中的能量变化过程如图,则下列有关说法正确的是( )
8. 下列叙述中,正确的是( )A、某物质中只含有一种元素,该物质一定是纯净物 B、含有共价键的化合物一定是共价化合物 C、含有离子键的化合物一定是离子化合物 D、离子化合物只含离子键9. 已知X+Y═M+N反应中的能量变化过程如图,则下列有关说法正确的是( )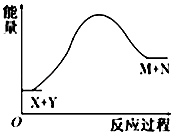 A、X的能量一定低于M的能量,Y的能量一定低于N的能量 B、因为该反应为吸热反应,故一定要加热反应才能进行 C、破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 D、X和Y的总能量一定低于M和N的总能量10. 控制变量法是化学实验的常用方法之一.下图实验探究影响反应速率的因素是( )
A、X的能量一定低于M的能量,Y的能量一定低于N的能量 B、因为该反应为吸热反应,故一定要加热反应才能进行 C、破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 D、X和Y的总能量一定低于M和N的总能量10. 控制变量法是化学实验的常用方法之一.下图实验探究影响反应速率的因素是( )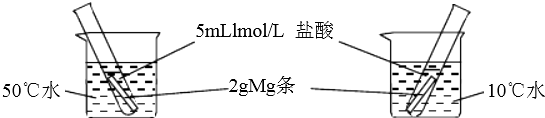 A、浓度 B、温度 C、催化剂 D、固体质量11. 短周期元素X和元素Y,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a﹣b),L层电子数为(a+b),则X、Y两元素形成的化合物可能具有的性质是( )A、和水反应 B、和硫酸反应 C、和氢氧化钠反应 D、和氯气反应12. 如图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R是其中的五种元素.下列说法不正确的是( )
A、浓度 B、温度 C、催化剂 D、固体质量11. 短周期元素X和元素Y,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a﹣b),L层电子数为(a+b),则X、Y两元素形成的化合物可能具有的性质是( )A、和水反应 B、和硫酸反应 C、和氢氧化钠反应 D、和氯气反应12. 如图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R是其中的五种元素.下列说法不正确的是( )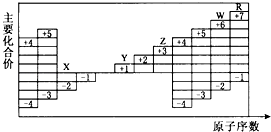 A、原子半径:Y>X B、最高价氧化物的水化物的酸性:R>W C、气态氢化物的稳定性:X>W D、单质与水(或酸)反应的剧烈程度:Z>Y13. 下列有关金属及金属材料的说法不正确的是( )A、合金的性能一般优于纯金属 B、碳素钢是目前用量最大的合金,碳素钢在空气中比纯铁耐腐蚀 C、酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面生成一层致密的氧化膜 D、用金属铝与V2O5反应冶炼钒,主要是因为铝的还原能力比钒强14. 下列各组混合物,使用氢氧化钠溶液和盐酸两种试剂不能分离的是( )A、氧化镁中混有氧化铝 B、氯化铝溶液中混有氯化铁 C、氧化铁中混有二氧化硅 D、氯化亚铁溶液中混有氯化铜15. 某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32﹣、Cl﹣、OH﹣、NO3﹣ . 向该溶液中加入铝粉,只放出H2 , 则溶液中能大量存在的离子最多有( )A、3种 B、4种 C、5种 D、6种16. 研究发现,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( )
A、原子半径:Y>X B、最高价氧化物的水化物的酸性:R>W C、气态氢化物的稳定性:X>W D、单质与水(或酸)反应的剧烈程度:Z>Y13. 下列有关金属及金属材料的说法不正确的是( )A、合金的性能一般优于纯金属 B、碳素钢是目前用量最大的合金,碳素钢在空气中比纯铁耐腐蚀 C、酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面生成一层致密的氧化膜 D、用金属铝与V2O5反应冶炼钒,主要是因为铝的还原能力比钒强14. 下列各组混合物,使用氢氧化钠溶液和盐酸两种试剂不能分离的是( )A、氧化镁中混有氧化铝 B、氯化铝溶液中混有氯化铁 C、氧化铁中混有二氧化硅 D、氯化亚铁溶液中混有氯化铜15. 某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32﹣、Cl﹣、OH﹣、NO3﹣ . 向该溶液中加入铝粉,只放出H2 , 则溶液中能大量存在的离子最多有( )A、3种 B、4种 C、5种 D、6种16. 研究发现,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( ) A、OC段离子反应方程式为H++OH﹣═H2O B、溶液中n(NH )=0.012 mol C、溶液中结合OH﹣能力最强的离子是H+ , 最弱的离子是Al3+ D、欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量
A、OC段离子反应方程式为H++OH﹣═H2O B、溶液中n(NH )=0.012 mol C、溶液中结合OH﹣能力最强的离子是H+ , 最弱的离子是Al3+ D、欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量二、非选择题
-
17.
如图是某化学小组设计的制取氯气并以氯气为反应物进行特定反应的装置,其中D装置试管内盛有水,烧杯内为沸水浴.
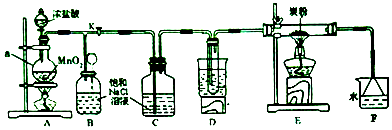
回答下列问题:
(1)、仪器a的名称是;其中反应的化学方程式是 .(2)、C装置的作用是 .(3)、E装置中发生氧化还原反应,生成CO2和HCl(g),写出发生反应的化学方程式 . D装置的作用是 .(4)、E装置中反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A装置中仍有Cl2产生,则B装置中的现象是 .(5)、量取20mLF装置中溶液,倒入分液漏斗中,然后再注入10mLCCl4 , 盖好玻璃塞,振荡,静置、分层后分别取上层液和下层液进行试验,其中能使有色布条褪色的是(填“上层液”或“下层液”).(6)、F装置中倒置漏斗的主要作用是 .18. 铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料.实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2•12H2O]的工艺流程如图所示:
请回答下列问题:
(1)、固体a的化学式为 , Ⅲ中通入足量CO2气体发生反应的离子方程式为 .(2)、由Ⅴ 制取铵明矾溶液的化学方程式为 . 从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤.(3)、以1000kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3 , 需消耗质量分数98%的硫酸(密度1.84g•cm﹣1)L(计算结果请保留一位小数).(4)、若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量.若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为 .19. X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素,W为过渡元素,它们的相关信息如表:原子或分子相关信息
单质及其化合物相关信息
X
ZX4分子是由粗Z提纯Z的中间产物
X的最高价氧化物对应的水化物为无机酸中最强酸
Y
Y原子的最外层电子数等于电子层数
Y的氧化物是典型的两性氧化物,可用于制造一种高温材料
Z
Z原子的最外层电子数是次外层电子数的
Z广泛存在于无机非金属材料中,其单质是制取大规模集成电路的主要原料
W
W原子的最外层电子数小于4
W的常见化合价有+3、+2,WX3稀溶液呈黄色
回答下列问题:
(1)、W在周期表的位置为 , W(OH)2在空气中不稳定,极易被氧化反应的化学方程式为 .(2)、X的简单阴离子的结构示意图为;X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 .(3)、Z的氧化物在通讯领域的用途是 , 工业上制备Z的单质的化学反应方程式为 .(4)、YX3固体在熔融状态下不导电,则YX3固体中存在键;在50mL 1mol•L﹣1的YX3溶液中逐滴加入0.5mol•L﹣1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积可能有种情况.20. 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号
室温下,试管中所加试剂及其用量/mL
室温下溶液颜色褪至无色所需时间/min
0.6 mol/L
H2C2O4溶液
H2O
0.2 mol/L KMnO4溶液
3 mol/L
稀硫酸
1
3.0
2.0
3.0
2.0
4.0
2
3.0
3.0
2.0
2.0
5.2
3
3.0
4.0
1.0
2.0
6.4
请回答:
(1)、根据上表中的实验数据,可以得到的结论是 .(2)、利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= .(3)、该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.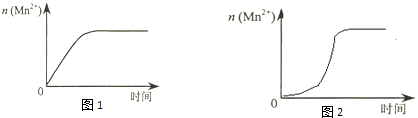
①该小组同学提出的假设是 .
②请你帮助该小组同学完成实验方案,并填写表中空白.
实验编号
室温下,试管中所加试剂及其用量/mL
再向试管中加入少量固体
室温下溶液颜色褪至无色所需时间/min
0.6 mol/L
H2C2O4溶液
H2O
0.2 mol/L KMnO4溶液
3 mol/L
稀硫酸
4
3.0
2.0
3.0
2.0
t
③若该小组同学提出的假设成立,应观察到的现象是 .